Fevarin – Fluvoxmine kosztuje do 30 PLN ! bez refundacji ! – ale w przychodniach i szpitalach się nie stosuje – niech ludzie umierają !
Średnia skuteczność terapii 89% ! – i zero ! śmierci wśród pacjentów !
A wszystko to wiadomo od lipca 2020 !
Policz ilu ludzi w tym czasie zamordowano brakiem leczenia !
Fluvoxamine – jedno op. 60 tab/50 mg starczy dla 4 (czterech) pacjentów
Badanie 1 Badanie 2 Badanie 3 Badanie 4 Badanie 5 – linki bezpośrednie do publikacji dla tych co nie wierzą !
Spis treści strony: wstępniak , potem badanie i wyniki potem linki.
Fluvoxamine – Komu dziękujemy ?
Brawo rząd RP i brawo „rada medyczna” przy Premierze Morawickim i brawo Premier, który tę radę powołał , nie zapomnijmy też podziękować Ministrowi Niedzielskiemu i pseudo ekspertom z TV.
I najważniejsze – oficjalne informacje o Fluwoksaminie pojawiły się w Polsce już w listopadzie 2020 – ale nikt z tym nic nie zrobił
Ostatecznie to producenci szczepionek zapewne płacą prowizję, a producenci Fevarinu pewnie nie chcieli – trudno się dziwić, że niektórzy czekali na szczepionkę.
Oto Oni „rada medyczna„, która nie jest zainteresowana Leczeniem Polaków ! – ile jeszcze śmierci potrzeba by Polacy zrozumieli, że są oszukiwani !
Znasz ich może i masz z nimi kontakt ?
Przekaż im ten tekst i swoją opinię – może wyślij im maila lub SMS lub zadzwoń, by zachęcić ich do czytania wyników badań klinicznych – może mają konta na FB lub TW – trzeba szukać w sieci – tam podobno jest wszystko !
Mogli zalecić !!! nieprzebadaną eksperymentalna szczepionkę to i mogą przebadany Fevarin – tylko czy zechcą ?
- Konsultant krajowy w dziedzinie medycyny rodzinnej – dr hab. Agnieszka Mastalerz-Migas https://ptmr.info.pl/konsultant-krajowy/
- Konsultant krajowy w dziedzinie chorób zakaźnych – prof. dr hab. Andrzej Horban http://zakazny.pl/konsultant/ https://zakazny.pl/koronawirus/
- Konsultant krajowy w dziedzinie anestezjologii i intensywnej terapii – prof. dr hab. Radosław Owczuk http://konsait.pl/
Członkowie Rady Medycznej: https://gazetalekarska.pl/?p=58199
- prof. dr hab. n. med. Magdalena Marczyńska – Warszawski Uniwersytet Medyczny, Klinika Chorób Zakaźnych Wieku Dziecięcego,
- prof. dr hab. n. med. Jacek Wysocki – kierownik Katedry i Zakładu Profilaktyki Zdrowotnej, Wydział Nauk o Zdrowiu, Uniwersytet Medyczny w Poznaniu,
- prof. dr hab. n. med. Robert Flisiak – prezes Polskiego Towarzystwa Epidemiologów i Lekarzy Chorób Zakaźnych,
- prof. dr hab. n. med. Krzysztof Simon – Uniwersytet Medyczny we Wrocławiu,
- prof. dr hab. n. med. Tomasz Laskus – Warszawski Uniwersytet Medyczny, Zakład Immunopatologii Chorób Zakaźnych i Pasożytniczych,
- prof. dr hab. n. med. Anna Piekarska – Uniwersytet Medyczny w Łodzi, Katedra i Klinika Chorób Zakaźnych i Hepatologii,
- prof. dr hab. n. med. Miłosz Parczewski – Pomorski Uniwersytet Medyczny w Szczecinie, Klinika Chorób Zakaźnych, Tropikalnych i Nabytych Niedoborów Immunologicznych,
- prof. dr hab. n. med. Krzysztof Tomasiewicz – Uniwersytet Medyczny w Lublinie, Katedra i Klinika Chorób Zakaźnych,
- prof. dr hab. n. biol. Krzysztof Pyrć – Uniwersytet Jagielloński w Krakowie, Małopolskie Centrum Biotechnologii UJ,
- prof. dr hab. n. med. Radosław Owczuk – Gdański Uniwersytet Medyczny, kierownik Katedry Anestezjologii i Intensywnej Terapii,
- dr hab. n. med. Agnieszka Mastalerz-Migas – Uniwersytet Medyczny we Wrocławiu, kierownik Katedry i Zakładu Medycyny Rodzinnej,
- dr hab. n. med. Iwona Paradowska-Stankiewicz – Narodowy Instytut Zdrowia Publicznego, Krajowy konsultant w dziedzinie epidemiologii,
- dr n med. Artur Zaczyński – CSK MSWiA,
- prof. dr hab. n. med. Małgorzata Pawłowska – kierownik Katedry Chorób Zakaźnych i Hepatologii Collegium Medicum w Bydgoszczy, Uniwersytetu Mikołaja Kopernika w Toruniu, wice Prezes Polskiego Towarzystwa Epidemiologów i Lekarzy Chorób Zakaźnych,
- prof. dr hab. n. med. Bartosz Łoza – kierownik Kliniki Psychiatrii Warszawskiego Uniwersytetu Medycznego,
- dr n. med. Konstanty Szułdrzyński – Uniwersytet Jagielloński Collegium Medicum, kierownik Centrum Terapii Pozaustrojowych Szpitala Uniwersyteckiego w Krakowie.
Eutanazja – to także pozbawienie Pacjenta leczenia, pomimo, że istnieją takie możliwości i leki.
Jaka jest odpowiedzialność karna lekarza za zaniechanie leczenia?
W Polsce dostępna – Fevarin – tabletki powlekane – https://www.mp.pl/pacjent/leki/lek/99302,Fevarin-tabletki-powlekane
Żródło https://www.treatearly.org/fluvoxamine
Przegląd Badania
Fluvoxamine jest lekiem przeciwdepresyjnym zatwierdzonym przez FDA do leczenia depresji i zaburzeń obsesyjno-kompulsyjnych (OCD). Należy do klasy leków zwanych selektywnymi inhibitorami wychwytu zwrotnego serotoniny (SSRI). Duże, wieloośrodkowe badanie obserwacyjne we Francji wykazało, że SSRI ogólnie chronią przed COVID, a lek o największej aktywacji sigma-1 w badaniu (w tym przypadku fluoksetyna) zapewnia najlepszą ochronę. Hipoteza naukowców z Washington University to, że ochrona pochodzi z aktywacją sigma-1.
Wiadomo, że S1R hamuje cytokinę, substancję chemiczną w naszym organizmie, która jest aktywowana w niektórych infekcjach, takich jak Covid-19. Uważano, że za niektóre powikłania („Covid Pneumonia”) obserwowane u pacjentów z Covid-19 odpowiedzialna jest nadmierna odpowiedź zapalna, „Burza Cytokin”, która prowadzi do hospitalizacji i / lub konieczności leczenia respiratorem. Wybrali fluwoksaminę, ponieważ ze wszystkich SSRI, fluwoksamina ma największą aktywację Sigmy-1. O znaczeniu Sigma-1 napisał Francis Collins, dyrektor NIH . Collins napisał: „Pacjenci z COVID-19 przyjmujący… leki… ukierunkowane na SIGMAR1 byli o połowę mniejsi niż osoby przyjmujące inne rodzaje… leków wymagające wentylacji mechanicznej”.
Badania kliniczne
Przy wsparciu CETF na Uniwersytecie Waszyngtońskim w St. Louis przeprowadzono randomizowane, podwójnie zaślepione iw pełni zdalne badanie kliniczne prowadzone przez lekarzy medycyny Erica Lenze i lekarzy medycyny Angeli Reiersen, w których uczestniczyły 152 osoby, wszystkie w wieku 18 lat lub starszych, z objawami i zdiagnozowaną łagodną postacią COVID-19. Uczestnicy zostali losowo przydzieleni (1: 1) do przyjmowania fluwoksaminy lub placebo.
W tym badaniu z 80 uczestników, którzy otrzymali lek, żaden z pacjentów nie osiągnął punktu końcowego pogorszenia stanu klinicznego (zdefiniowanego jako osiągnięcie poziomu nasycenia krwi tlenem poniżej 92% i duszności wymagającej dodatkowego tlenu), w porównaniu z 6 osobami z 72, które dostał placebo i osiągnął kliniczny punkt końcowy. Podsumowując, wszyscy pacjenci leczeni fluwoksaminą nie osiągnęli punktu końcowego badania.Badanie pojawiło się jako główny artykuł w JAMA 12 listopada. Redaktorzy zauważyli, że wybrali to badanie spośród ponad 10 000 zgłoszeń COVID otrzymanych od lutego 2020 r. Zainteresowanie było duże: badanie było trzecim najpopularniejszym artykułem na temat JAMA w miesiącu Grudzień. Tydzień po opublikowaniu badania na torze wyścigowym Golden Gate Fields doszło do wybuchu COVID .
Wodór molekularny H2 pomaga w rehabilitacji po zakażeniu wirusem i walce z długim Covid-19.
Lekarz utwór, dr David Seftel , czytałem o badaniu JAMA tydzień przed i w dniu 21 listopada, rozpoczęła oferowanie jej pracowników. Początkowo tylko 35% pracowników zdecydowało się wypróbować lek. Dwa tygodnie później, po tym, jak pracownicy na własne oczy zobaczyli, co się stało z osobami, które zażyły lek w porównaniu z osobami, które odmówiły, istnieje 100% wskaźnik akceptacji leku. Pracownicy, którzy wcześniej odrzucili lek, zmienili zdanie i poprosili o lek.
Ogółem 48 pracowników odmówiło przyjęcia leku, 6 z nich było później hospitalizowanych, co oznacza 12,5% hospitalizacji. Dla porównania, wszystkich 77 pracowników, którzy otrzymywali lek (50 mg BID przez 14 dni), miało 0% wskaźnik hospitalizacji (z dowolnego powodu) i wszyscy mieli bardzo łagodne objawy i nie zgłaszali pogorszenia funkcji płuc ani funkcji poznawczych.
PlikBadanie Seftel zostało opublikowane w OFID ze specjalnym oznaczeniem „Editor’s Choice” 1 lutego 2021 r.
Wypowiedź lekarza Piotr Rubas na Konferencji w Krakowie! 27.02.2021
22 grudnia 2020 roku dziekan wydziału medycyny Uniwersytetu Emory wezwał do stosowania fluwoksaminy w praktyce klinicznej . 9 grudnia FastGrants wysłało wiadomość do wszystkich stypendystów: „Biorąc pod uwagę, że fluwoksamina jest stosunkowo bezpieczna, tania i powszechnie dostępna, zdecydowaliśmy się ogłosić zaproszenie do składania wniosków i danych dotyczących fluwoksaminy. Jesteśmy zainteresowani sfinansowaniem wszelkich badań RCT dotyczących fluwoksaminy które mogą być szybko zainicjowane lub inne powiązane prace (już finansujemy jeden RCT, który powinien rozpocząć się wkrótce). Jeśli masz pokrewną propozycję, odpowiednie dane (na temat fluwoksaminy, SSRI lub szerzej agonistów S1R) lub znasz kogokolwiek w innych przypadkach prosimy o przesłanie ich do nas. Chętnie poznamy zarówno pozytywne, jak i negatywne dane w tym obszarze.
CETF, FastGrants, Skoll Foundation i Cures Within Reach wspólnie sponsorują większą fazę 3 próby fluwoksaminy, która aktywnie rekrutuje uczestników od 29 stycznia 2021 r. Jest to zdalna próba dostępna dla każdego w Stanach Zjednoczonych i Kanadzie.
Fluwoksamina: przegląd mechanizmu działania i roli w COVID-19
- 1 Department of Medicine and the Morningside Center for Innovative and Affordable Medicine, School of Medicine, Emory University, Atlanta, GA, Stany Zjednoczone
- 2 Katedra Psychiatrii, School of Medicine, Washington University w St. Louis, St. Louis, MO, Stany Zjednoczone
- 3 Independent Researcher, Montgomery Village, MD, Stany Zjednoczone
- 4 GlobalCures, Inc., Newton, MA, Stany Zjednoczone
- 5 Wydział Epidemiologii, Rollins School of Public Health, Emory University, Atlanta, GA, Stany Zjednoczone
Fluwoksamina jest dobrze tolerowanym, szeroko dostępnym, niedrogim selektywnym inhibitorem wychwytu zwrotnego serotoniny, który został wykazany w małym, podwójnie ślepym, kontrolowanym placebo, randomizowanym badaniu, aby zapobiec klinicznemu pogorszeniu stanu pacjentów z łagodną chorobą koronawirusową 2019 (COVID-19). Fluwoksamina jest również agonistą receptora sigma-1, dzięki któremu kontroluje stan zapalny. Przeglądamy tutaj zbiór literatury, która pokazuje ważne mechanizmy działania fluwoksaminy i innych SSRI, które mogą odgrywać rolę w leczeniu COVID-19. Efekty te obejmują: zmniejszenie agregacji płytek krwi, zmniejszoną degranulację komórek tucznych, zakłócenie transportu wirusów endolizosomalnych, regulację stanu zapalnego wywoływanego przez enzym 1α wymagającego inozytolu oraz zwiększenie poziomu melatoniny, które łącznie mają bezpośrednie działanie przeciwwirusowe,
Wprowadzenie
Początkowo stosowana w leczeniu zaburzeń obsesyjno-kompulsywnych (OCD), fluwoksamina (FLV) wykazuje najsilniejsze działanie ze wszystkich SSRI na receptor sigma-1 (S1R) z niskim powinowactwem nanomolarnym ( Narita i wsp., 1996 ). Agonizm FLV na S1R nasila wzrost neurytów indukowany przez czynnik wzrostu nerwów (NGF) w komórkach PC 12 ( Nishimura i wsp., 2008 ; Ishima i wsp., 2014 ). S1R to białko opiekuńcze w siateczce endoplazmatycznej o właściwościach przeciwzapalnych ( Ghareghani et al., 2017 ). Działanie przeciwzapalne FLV prawdopodobnie wynika z regulacji S1R, która moduluje wrodzone i adaptacyjne odpowiedzi immunologiczne ( Szabo i wsp., 2014). S1R jest również ważnym regulatorem zapalenia wywołanego przez enzym 1α (IRE1) wymagającego inozytolu ( Rosen i wsp., 2019 ) ( Rysunek 1 ).
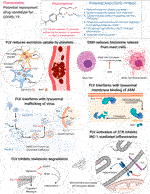 RYSUNEK 1 . Potencjalne mechanizmy działania fluwoksaminy przeciw COVID-19. Figura utworzona za pomocą Biorender.
RYSUNEK 1 . Potencjalne mechanizmy działania fluwoksaminy przeciw COVID-19. Figura utworzona za pomocą Biorender.
FLV i inne SSRI regulują aktywność cytokin zapalnych i ekspresję genów zarówno w komórkowych, jak i zwierzęcych modelach zapalenia ( Taler i wsp., 2007 ; Tynan i wsp., 2012 ; Rafiee i wsp., 2016 ; Ghareghani i wsp., 2017 ; Naji Esfahani i in., 2019 ; Rosen i in., 2019 ). Potencjał FLV do tłumienia burzy cytokinowej ma wpływ na COVID-19. Ciężkość COVID-19 jest związana ze zwiększonym poziomem mediatorów stanu zapalnego, w tym cytokin i chemokin ( Chen G. i wsp., 2020 ; Chen N. i wsp., 2020 ; Huang i wsp., 2020 ; Tay i wsp., 2020). Donoszono, że inni agoniści S1R, tacy jak fluoksetyna, mają działanie przeciwwirusowe ( Zuo i wsp., 2012 ; Bauer i wsp., 2019 ). Badania te wzbudziły zainteresowanie potencjalną rolą terapeutyczną agonistów FLV i S1R w COVID-19 ( Vela, 2020 ; Hashimoto, 2021 ).
Ten przegląd ilustruje mechanizmy działania leżące u podstaw przeciwzapalnych i przeciwwirusowych właściwości FLV. Obejmuje badania przedkliniczne dotyczące wpływu agonistów FLV i S1R na stan zapalny i podsumowuje obecnie dostępne dane kliniczne dotyczące leczenia FLV w COVID-19.
Wskazania do fluwoksaminy
Maleinian fluwoksaminy jest dostępny w postaci tabletek o natychmiastowym uwalnianiu i kapsułek o kontrolowanym uwalnianiu. FLV jest wskazany w leczeniu obsesji i kompulsji u pacjentów z OCD. Okres półtrwania FLV wynosi 9–28 godzin w zależności od preparatu, a zalecana dawka to 100–300 mg / dobę ( FDA, 2012 ).
Oryginalny mechanizm działania
Hamowanie transportera serotoniny
FLV blokuje wychwyt zwrotny serotoniny w zależnym od sodu transporcie serotoniny (SERT) błony neuronalnej, wzmacniając działanie serotoniny na autoreceptory 5HT1A ( Dell’Osso i wsp., 2005 ; FDA, 2012 ). FLV ma znikome powinowactwo do receptorów α1-, α2-, β-adrenergicznych, muskarynowych, dopaminy D2, histaminy H1, GABA-benzodiazepiny, opiatów, 5-HT1 lub 5-HT2 ( Irons, 2005 ).
Prawdopodobne mechanizmy działania w COVID-19
Agregacja płytek krwi
Płytkom krwi brakuje enzymu do syntezy serotoniny ( Ni i Watts, 2006 ). SERT umożliwia szybkie pobieranie serotoniny z osocza ( Vanhoutte, 1991 ). Podczas zakrzepicy płytki krwi uwalniają serotoninę, ułatwiając hemostazę poprzez agregację płytek ( Berger i wsp., 2009 ) ( ryc. 1 ) i sprzyjają rekrutacji neutrofili ( Duerschmied i wsp., 2013 ). SSRI mogą zatem wydłużać czas krwawienia ( Leung i Shore, 1996 ) lub obniżać poziom serotoniny w surowicy o> 80% i zmniejszać rekrutację neutrofili ( Duerschmied i in., 2013 ). Płytki krwi od osób leczonych SSRI i płytki krwi od myszy pozbawionych SERT wykazują zmniejszoną agregację ( Celada i wsp., 1992; Carneiro i in., 2008 ; McCloskey i in., 2008 ). Wskaźniki krzepnięcia i hemostazy były niższe u pacjentów z lekami przeciwdepresyjnymi o działaniu serotoninergicznym niż u pacjentów bez leków przeciwdepresyjnych o działaniu serotoninergicznym ( Geiser i wsp., 2011 ). Stan hiperserotonergiczny rozróżnia zespół ostrej niewydolności oddechowej COVID-19 i nie-COVID-19, biochemicznie ( Zaid i wsp., 2021 ) i klinicznie ( Helms i wsp., 2020a ; Helms i wsp., 2020b ). Jest to prawdopodobnie patologiczne w wielu narządach (podobne do zespołu serotoninowego, F. Jalali – osobista obserwacja i komunikacja) i może wywodzić się z układu immunologicznego ( Althaus i in., 2020 ; Nazy i in., 2021) stan nadreaktywności płytek krwi ( Zaid i wsp., 2021 ), w wyniku którego dochodzi do rumieniowatej degranulacji serotoniny w osoczu.
Jednoczesne upośledzenie wychwytu zwrotnego serotoniny może zaostrzyć ten stan hiperserotoninergiczny. Klirens serotoniny zależy od zdrowego śródbłonka płuc ( Thomas i Vane, 1967 ; Joseph i wsp., 2013 ), który jest uszkodzony w wyniku COVID-19 ( Ackermann i wsp., 2020 ). Uwalnianie serotoniny przez płytki krwi można zmniejszyć przy przewlekłym lub wczesnym stosowaniu SSRI de novo ( Cloutier i wsp., 2018 ), ponieważ SSRI zmniejszają zawartość serotoniny w płytkach krwi ( Narayan i wsp., 1998 ; Javors i wsp., 2000 ). Rozpoczęcie de novo SSRI w późniejszym terminiestadia od umiarkowanego do ciężkiego COVID-19 mogą być jednak nieprzewidywalnie szkodliwe, biorąc pod uwagę istniejący stan hiperserotonergiczny ( Zaid i in., 2021 ), chyba że zostaną zrównoważone innymi korzystnymi skutkami SSRI. Rzeczywiście, na tym etapie bezpośredni antagonizm serotoninowy skierowany specyficznie na receptory serotoniny 2 A, B i C z lekami takimi jak cyproheptadyna lub mirtazapina może być korzystny i jest badany (F. Jalali – komunikacja osobista).
Trzy badania oceniające korzyści ze stosowania antykoagulantów w leczeniu COVID-19 wstrzymały rekrutację krytycznie chorych pacjentów z COVID-19, którzy wymagają wsparcia na oddziale intensywnej terapii (OIOM) ( NHLBI, 2020 ). Terapeutyczne leki rozrzedzające krew nie zmniejszyły potrzeby przyjmowania na OIOM w tej grupie pacjentów. Ponieważ pełne dawki terapeutycznych antykoagulantów zwiększają ryzyko krwawienia wewnętrznego, FLV może być może bezpieczniej hamować krzepnięcie krwi.
Degranulacja komórek tucznych
Ludzkie komórki tuczne (MC) są rezerwuarem wirusów dla wirusów RNA, takich jak HIV ( Sundstrom i wsp., 2004 ). Indukowalne przez kwas retinowy receptory podobne do genów I komórek tucznych mogą wykrywać wirusy RNA ( Fukuda i wsp., 2013 ). Wirusy mogą powodować degranulację MC w szlaku zależnym od sfingozyny-1-fosforanu (S1P) ( Wang i wsp., 2012 ). MCs wyrażają enzym konwertujący angiotensynę 2 (ACE2), główny receptor wejścia SARS-CoV-2 do komórek, definiując w ten sposób drogę, po której MC mogą stać się gospodarzami dla tego wirusa ( Theoharides, 2020 ). Pośmiertne biopsje płuc pacjentów z COVID-19 powiązały obrzęk płuc i zakrzepicę z aktywowanymi MCs ( Motta Junior i wsp., 2020 ). Leki przeciwdepresyjne zmniejszają również uwalnianie histaminy z MC (Ferjan i Erjavec, 1996 ). SSRI, takie jak fluoksetyna, obniżyły poziom mRNA proteazy-1 w MCs ( Chen et al., 2008 ). W związku z tym, inhibitory wychwytu zwrotnego serotoniny, jak FLV może zmniejszyć burze cytokin w COVID-19 pacjentów ( Figura 1 ), ze względu na nietypowy reakcji MC do SARS-CoV-2.
Lizosomotropizm
Agoniści S1R, tacy jak FLV i fluoksetyna, są lizosomotropami ( Hallifax i Houston, 2007 ; Kazmi i wsp., 2013 ). Fluwoksamina ma przewidywane pKa 8,86 ( DrugBank, 2005 ; Wishart i wsp., 2018 ) i jest podatna na protonowanie w fizjologicznym zakresie pH. Mniej polarne, uzwiązkowione formy podstawowych leków mogą łatwo przenikać przez błony. Podstawowe leki, takie jak FLV, mogą ulec protonowaniu w lizosomie, co utrudnia teraz naładowanym cząsteczkom przechodzenie przez błony. β-koronawirusy, takie jak SARS-CoV-2 i mysi wirus zapalenia wątroby (MHV), wykorzystują transport lizosomalny do ucieczki z zakażonych komórek ( Ghosh i wsp., 2020 ) ( ryc.1 ). GRP78 / BIP, chaperon ułatwiający zakaźność koronawirusa ( Chu et al., 2018; Ha i wsp., 2020 ), jest uwalniany wspólnie z β-koronawirusami tą drogą ( Ghosh i wsp., 2020 ). Białko 3A z otwartą ramką odczytu SARS-CoV (ORF3a) ( Gordon i wsp., 2020 ) jest wiroporyną, która lokalizuje się w lizosomach ( Ghosh i wsp., 2020 ), zaburza ich zakwaszenie ( Yue i wsp., 2018 ) i przyczynia się do do wyjścia wirusa ( Lu i in., 2006 ; Castano-Rodriguez i in., 2018 ; Yue i in., 2018 ). Biorąc pod uwagę lizosomalny wypływ β-koronawirusów z zakażonych komórek, leki lizosomotropowe, takie jak FLV, mogą mieć działanie przeciwwirusowe w lizosomach obciążonych wirusem ( Homolak i Kodvanj, 2020 ) ( Rysunek 1 ).
Kwaśna sfingomielinaza
Leki Lysosomotropic przemieszczać kwasu sfingomielinazy (ASM), z błon lizosomalnych prowadzących do rozkładu ( Breiden i Sandhoffa, 2019 ) ( Figura 1 ). Leczenie myszy agonistami S1R, takimi jak fluoksetyna ( Hashimoto, 2015 ), zmniejsza zarówno aktywność kwaśnej sfingomielinazy, jak i poziom białka w neuronach ( Gulbins et al., 2013 ). Jest to zgodne z częściową proteolizą kwaśnej sfingomielinazy przez fluoksetynę ( Kornhuber et al., 2008 ). Fluoksetyna może skutecznie hamować wejście i namnażanie SARS-CoV-2 w liniach komórkowych Vero-E6 ( Schloer i wsp., 2020 ). Wywiera również działanie przeciwwirusowe przeciwko podtypom wirusa grypy A ( Schloer et al., 2020). Agoniści S1R, tacy jak escitalopram i fluoksetyna ( Hashimoto, 2015 ), mogą zapobiegać zakażeniu komórek Vero cząstkami pseudowirusowymi wirusa pęcherzykowego zapalenia jamy ustnej prezentującymi spike białko SARS-CoV-2 (pp-VSV-SARS-CoV-2) ( Carpinteiro et al., 2020 ). Leki przeciwdepresyjne, takie jak amitryptylina, zapobiegały również zakażeniu ludzkich komórek Caco-2 SARS-CoV-2, a leczenie ochotników niską dawką amitryptyliny zapobiegało zakażeniu świeżo izolowanych komórek nabłonka nosa kolcem pp-VSV-SARS-CoV-2 ( Carpinteiro et al. ., 2020 ). Hamowanie kwaśnej sfingomielazy przez te leki może zapobiegać przekształcaniu sfingomieliny w fosforylocholinę i ceramid. Ponieważ wysoki poziom ceramidów w błonie komórkowej ułatwia wnikanie wirusów, to zmniejszenie zawartości ceramidów może zapobiegać infekcji (Carpenteiro i in., 2020 ). Dlatego też funkcjonalne hamowanie kwaśnej sfingomielinazy przez leki lizosomotropowe jest kolejną drogą kontroli wirusów przez leki przeciwdepresyjne.
Aktywność receptora Sigma-1
S1R odkryto w 1976 r. ( Martin i wsp., 1976 ) i sklonowano w 1996 r. ( Hanner i wsp., 1996 ). Reguluje sygnalizację i przeżycie komórek w mitochondrialnym Ca 2+ w ER ( Hayashi i Su 2007 ). Celowanie w S1R za pomocą FLV reguluje produkcję cytokin w ludzkich komórkach dendrytycznych pochodzących z monocytów ( Szabo i wsp., 2014 ). Makrofagi pochodzące ze szpiku kostnego (BMDM) z nokautem S1R (KO) były prozapalne w modelach wstrząsu endotoksycznego. Mieli wyższe poziomy mRNA IL-6 i IL-1 β oraz zwiększone wydzielanie białka IL-6 w porównaniu z BMDM typu dzikiego (WT) ( Rosen i wsp., 2019 ). Natomiast ekspresja cytokiny przeciwzapalnej IL-10 nie uległa zmianie w BMDM S1R KO ( Rosen et al., 2019). Nadekspresja S1R w HEK wykazujących ekspresję mTLR4 / MD2 / CD14 była przeciwzapalna w modelu wstrząsu endotoksycznego. W porównaniu z HEK z normalnymi poziomami S1R, komórki z wyższymi poziomami S1R miały niższe poziomy IL-8 podczas stymulacji LPS ( p <0,05). W innych systemach FLV reguluje w górę IL-10 ( Kalkman i Feuerbach, 2016 ; Nazimek i in., 2017 ). FLV poprzez S1R może zatem modulować stan hiper-zapalny wywołany przez SARS-CoV-2 ( ryc. 1 ).
Z drugiej strony, ekrany zaburzeń genetycznych wykazały zmniejszenie ilości S1R, zmniejszenie replikacji wirusa SARS-CoV-2 w liniach komórek nabłonka podstawnego pęcherzyka płucnego gruczolakoraka ludzkiego z ekspresją enzymu konwertującego angiotensynę I 2 (A549-ACE2) ( Gordon i wsp., 2020 ). Zgodnie z tymi danymi genetycznymi agoniści S1R, tacy jak dekstrometorfan, mogą zwiększać replikację wirusa ( Gordon i wsp., 2020 ). Jednak z drugiej strony badacze przeglądający dane dotyczące rachunków medycznych dla prawie 740000 pacjentów z COVID-19 w Stanach Zjednoczonych wykazali, że pacjenci przyjmujący leki przeciwpsychotyczne celowane w S1R byli o połowę bardziej skłonni do konieczności wentylacji mechanicznej niż osoby stosujące inne rodzaje leków przeciwpsychotycznych ( Gordon i in., 2020 ).
Neurotropizm jest jedną wspólną cechą ludzkich koronawirusów ( Bale, 2015 ; Dube i in., 2018 ). Różne receptory mogą być zaangażowane w neurotropizm i wchodzenie do komórek nerwowych SARS-CoV-2 ( Armocida i wsp., 2020 ). Receptory Sigma są szeroko wyrażane w OUN ( Yesilkaya i wsp., 2020 ). Zmniejszenie ekspresji białka S1R upośledza inicjację replikacji RNA wirusa zapalenia wątroby typu C (HCV) w ludzkich komórkach wątrobiaka ( Friesland i wsp., 2013 ). BD1047 selektywny antagonista S1R zablokował stymulację, w której pośredniczy kokaina, ekspresji ludzkiego wirusa niedoboru odporności (HIV-1) w neuronalnych jednojądrzastych fagocytach, takich jak mikroglej ( Gekker et al., 2006). S1R może zatem brać udział w przenoszeniu przez neurony innych wirusów RNA, takich jak SARS-CoV-2.
Enzym 1α wymagający inozytolu i autofagia
TLR4 stymulowany endotoksynami aktywuje IRE1 (Martinon i wsp., 2010 ) i reguluje produkcję cytokin prozapalnych ( Qiu i wsp., 2013 ). Białko SARS-CoV E reguluje w dół szlak IRE1, a SARS-CoV pozbawiony genu otoczki (E) (rSARS-CoV-ΔE) jest atenuowany in vivo ( DeDiego i wsp., 2011 ). Inhibitory IRE1, takie jak STF-083010, uratowały myszy S1R KO w modelu endotoksemii ( Rosen i wsp., 2019 ). IRE1 jest niezbędny do autofagii podczas infekcji wirusem zakaźnego zapalenia oskrzeli (IBV) – koronawirusem gamma ( Fung i Liu, 2019 ). Białka replikazy SARS-CoV nsp2, 3 i 8 występują w kompleksach cytoplazmatycznych i kolokalizują się z LC3, białkowym markerem wakuoli autofagicznych (Prentice i in., 2004 ). Wirusowe białko replikazy nsp6 IBV aktywuje autofagię w badaniu przesiewowym ( Cottam i wsp., 2011 ). Inne omówione tu badania ( Yang i Shen, 2020 ) sugerują, że autofagia nie jest bezpośrednio związana z SARS-CoV. Te rozbieżności są prawdopodobnie spowodowane różnymi wirusami i komórkami testowanymi w różnych badaniach.
Melatonina
Wirus SARS-CoV-2 może aktywować inflamasom NLRP3 ( van den Berg i Te Velde, 2020 ), który wraz z aktywacją NF-κB może wywołać burzę cytokinową ( Ratajczak i Kucia, 2020 ). Melatonina może łagodzić stan zapalny poprzez te szlaki, a ekspozycja na melatoninę po intubacji wiąże się z pozytywnym wynikiem u pacjentów z COVID-19 (i nie-COVID-19) ( Garcia i wsp., 2015 ; Ramlall i wsp., 2020 ). FLV może podnosić poziomy melatoniny poprzez hamowanie CYP1A2, członka nadrodziny enzymów cytochromu P450 ( Hartter i wsp., 2001 ) ( Rysunek 1 ).
Czy selektywne inhibitory wychwytu zwrotnego serotoniny i agoniści receptora Sigma-1 mogą mieć bezpośredni wpływ przeciwwirusowy na inne wirusy?
Precedens do stosowania selektywnych inhibitorów wychwytu zwrotnego serotoniny w leczeniu innych infekcji wirusowych
Enterowirusy to wirusy RNA bez otoczki. Ich niestrukturalne białko 2C jest jednym z ich najbardziej konserwatywnych białek i zawiera aktywność ATPazy i przypuszczalną aktywność helikazy RNA ( Cheng et al., 2013 ). Fluoksetyna wykazuje in vitro działanie przeciwwirusowe przeciwko gatunkom Enterowirusów B i D ( Zuo i in., 2012 ; Ulferts i in., 2013 ). Fluoksetyna bezpośrednio wiąże niestrukturalne białko 2C ( Manganaro i wsp., 2020 ). Niektóre odporne na fluoksetynę warianty enterowirusów, takie jak wirus Coxsackie B3 i B4, mają mutacje w białku 2C ( Ulferts i wsp., 2013 ; Alidjinou i wsp., 2019). Potwierdza to pogląd, że interakcja między fluoksetyną a białkiem 2C ma zasadnicze znaczenie dla jej działania przeciwwirusowego.
Odpowiedź na stres retikulum endoplazmatycznego
Infekcja wirusowa może wywołać odpowiedź niepofałdowanego białka (UPR). Jest to reakcja na stres ER z powodu przeciążenia ER białkami kodowanymi przez wirusy ( Kim i wsp., 2008 ), a także może wywoływać autofagię ( Bernales i wsp., 2006 ; Ogata i wsp., 2006 ). Białka sygnalizacyjne ER, takie jak IRE1, kinaza PRKR-podobna do ER (PERK) i aktywujący czynnik transkrypcji 6 (ATF6) regulują UPR. UPR bierze udział w replikacji wirusa i moduluje wrodzone odpowiedzi gospodarza ( Xue i wsp., 2018 ). Stres ER wywołany przez wirusy jest wymagany do aktywacji autofagii, replikacji wirusa i patogenezy dengi ( Lee i in., 2018 ). Mysi cytomegalowirus aktywuje szlak IRE1 w celu złagodzenia represji przez białko wiążące X-box 1 nie poddane procesowi mRNA (Hinte i in., 2020 ). Zakażenie koronawirusem wywołuje stres ER i wyzwala UPR ( Fung i in., 2016 ). Białko S w β-koronawirusach moduluje UPR, aby ułatwić replikację wirusa ( Chan i wsp., 2006 ; Versteeg i wsp., 2007 ). Koronawirus α, zakaźny wirus zapalenia żołądka i jelit (TGEV), wyzwala stres ER wywołany przez UPR głównie poprzez aktywację osi PERK-eukariotycznego czynnika inicjacji 2α ( Xue i in., 2018 ). Zatem reakcja na stres ER ma kluczowe znaczenie dla interakcji gospodarza z wirusem w różnych infekcjach. Omówiliśmy powyżej, w jaki sposób S1R jest regulatorem IRE1 i autofagii. Agoniści S1R, tacy jak FLV, mogą zatem odgrywać rolę w regulacji infekcji wirusowych poza SARS-CoV-2 poprzez domniemaną regulację stresu ER i UPR.
Przedkliniczne działanie fluwoksaminy na stan zapalny
Myszy S1R KO wykazują zwiększoną śmiertelność w porównaniu z WT w subletalnych modelach sepsy ( Rosen i wsp., 2019 ). Szczytowy poziom TNF i IL-6 w surowicy był podwyższony u myszy S1R KO poddanych prowokacji LPS. Ligand S1R FLV zwiększał przeżycie w mysich modelach zapalenia, w którym pośredniczy IRE1 i zapalenia otrzewnej wywołanego kałem. Leczenie FLV chroniło myszy WT przed śmiercią wywołaną wstrząsem endotoksycznym, podczas gdy u zwierząt S1R KO nie zaobserwowano żadnego znaczącego efektu, co sugeruje, że w działaniu przeciwzapalnym FLV prawdopodobnie pośredniczy S1R.
Stwardnienie rozsiane (SM) to przewlekła, zapalna, demielinizacyjna choroba neurodegeneracyjna. Wykazano, że SSRI, takie jak sertralina, mają działanie immunomodulujące w eksperymentalnym autoimmunologicznym zapaleniu mózgu i rdzenia (EAE), mysim modelu SM ( Taler i wsp., 2011 ) oraz w szczurzym modelu reumatoidalnego zapalenia stawów ( Baharav i wsp., 2012 ). FLV zmniejsza nasilenie EAE u szczurów, nawet jeśli leczenie rozpoczęto 12 dni po indukcji EAE ( Ghareghani i wsp., 2017 ). Szczury EAE leczone FLV wykazały spadek poziomów IFN-γ w surowicy i wzrost odpowiednio IL-4, cytokin pro i przeciwzapalnych, w porównaniu do nieleczonych szczurów EAE. Dawka FLV zastosowana w tych eksperymentach ekstrapoluje (według pola powierzchni) na dawki FLV zatwierdzone do stosowania u ludzi.
Zatem wydaje się, że FLV łagodzi stan zapalny w różnych modelach zapalenia in vivo . Dane na temat zakażenia SARS-CoV-2 u naczelnych innych niż ludzie lub chomika rzucą dodatkowe światło na to, czy FLV może być użytecznym lekiem dla pacjentów z COVID-19 i na mechanizm (y) w grze.
Kliniczne skutki fluwoksaminy w COVID-19
W podwójnie ślepym, randomizowanym, wstępnym badaniu dorosłych pacjentów ambulatoryjnych z objawowym COVID-19, 80 pacjentów leczonych FLV w porównaniu z 72 leczonymi placebo miało mniejsze prawdopodobieństwo pogorszenia stanu klinicznego w ciągu 15 dni ( Lenze i wsp., 2020). Kwalifikujących się pacjentów włączano w ciągu 7 dni od pojawienia się objawów. Dane te są prowokacyjne, gdyż stan żadnego z pacjentów leczonych FLV nie pogorszył się w porównaniu z 8,3% pacjentów w grupie kontrolnej, u których stwierdzono pogorszenie stanu klinicznego. Uczestnicy otrzymali 50 mg FLV QD pierwszego dnia, następnie przez 2 dni 100 mg FLV BID, a następnie 100 mg FLV TID zgodnie z tolerancją do dnia 15, a następnie zaprzestali. W prospektywnym badaniu dotyczącym stosowania FLV we wczesnym leczeniu COVID-19 częstość hospitalizacji wynosiła 0% (0/65) z FLV i 12,5% (6/48) z samą obserwacją. Po 14 dniach 0% (0/65) osób leczonych FLV miało trwałe objawy resztkowe w porównaniu z 60% (29/48) wśród osób, które nie zdecydowały się na terapię ( Seftel i Boulware, 2021 ). Agoniści S1R, tacy jak escitalopram i fluoksetyna, byli związani z mniejszym ryzykiem intubacji lub zgonu (p <0,05) z powodu COVID-19 w wieloośrodkowym retrospektywnym badaniu kohortowym ( Hoertel i in., 2021 ).
Biorąc pod uwagę liczne role S1R omówione tutaj w zapaleniu, agregacji płytek krwi, aktywności przeciwwirusowej itp. Oraz ostatnie uderzające dane dotyczące ludzi, jest prawdopodobne, że agoniści S1R, tacy jak FLV, mogą mieć duży wpływ na progresję choroby u pacjentów z COVID-19 we wczesnym stadium choroby.
Dyskusja
Trwa randomizowane badanie z udziałem 880 pacjentów, które powinno dostarczyć ostatecznych odpowiedzi ( Lenze, 2020 ). Pacjenci z całego kraju mogą uczestniczyć w tym badaniu z domu i bezpłatnie. Jednak biorąc pod uwagę obecny kryzys , który ma się pogorszyć, zanim szczepionka zacznie działać, można się zastanawiać, czy dowody FLV dotyczące COVID-19 są wystarczająco mocne, aby rozważyć zmianę wytycznych w praktyce, aby jeszcze szybciej gromadzić dane dotyczące wyników w COVID. 19 pacjentów ( Sukhatme i Sukhatme, 2021 ). Niewielka grupa systemów opieki zdrowotnej mogłaby rozważyć to podejście i jednocześnie stworzyć narzędzia, np. Lokalne lub regionalne repozytorium do śledzenia wyników w czasie rzeczywistym. Jeśli skuteczność jest podobna jak w małym badaniu z randomizacją ( Lenze i wsp., 2020), powinno to być ewidentne w takich danych. Nieostrożnie, wytyczne praktyki mogą nakłaniać opiekunów do rozważenia podania FLV tylko tym pacjentom z COVID-19 + z najwyższym ryzykiem progresji choroby i którzy nie mają dostępu do jednego z przeciwciał monoklonalnych, które otrzymały autoryzację do stosowania w nagłych wypadkach od FDA ( FDA, 2020a ; FDA, 2020b ). Ponadto wytyczne te mogą zostać zmienione w dowolnym momencie.
Należy zaplanować małe, intensywne badania biomarkerów, aby ocenić działanie przeciwwirusowe, immunomodulujące, przeciwzakrzepowe lub inne skutki u pacjentów leczonych FLV. Do takich badań można by włączyć narzędzia, takie jak analiza RNA i białek pojedynczych komórek. Podczas gromadzenia danych dotyczących ludzi przydatne byłyby dodatkowe dane przedkliniczne w systemach hodowli komórkowych, takie jak wspólne hodowle ludzkich komórek nabłonka i komórek układu odpornościowego ( Grunwell i in., 2019 ). Dane pochodzące od naczelnych innych niż ludzie i chomików dostarczyłyby cennych informacji na temat optymalnego czasu podania leku, ilości potrzebnej do uzyskania skuteczności i które spośród niezliczonych mechanizmów działania mogą być najbardziej istotne.
Modulacja serotoniny może odgrywać rolę w warunkach szpitalnych. Rzeczywiście, jeśli lek ten nie działa głównie jako środek przeciwwirusowy, ale raczej poprzez inne mechanizmy (np. Immunomodulujące, przeciwpłytkowe), może być skuteczny w takich sytuacjach, w których reakcje hiper-zapalne i zdarzenia zakrzepowe kierują patologią choroby. Jednakże, jak wspomniano wcześniej, należy zachować czujność w przypadku wystąpienia stanu hiperserotoninergicznego z podobieństwami do zespołu serotoninowego. W związku z tym sensowne może być rozpoczęcie leczenia fluwoksaminą u mniej poważnych pacjentów hospitalizowanych, ale podawanie antagonisty receptora serotoninowego 2 A, B i C, takiego jak cyproheptadyna lub mirtazapina, u cięższych pacjentów (razem z fluwoksaminą). Kuszące jest również spekulowanie na temat roli FLV w długodystansowych samolotach COVID-19. W tej heterogennej grupie prawdopodobnie znajdują się podgrupy, które mogą mieć nieprawidłową odpowiedź immunologiczną, która się utrzymywała, w której FLV może być skuteczny. Wreszcie, FLV może odgrywać rolę w leczeniu innych chorób wirusowych, w których występuje pewna wersja burzy cytokinowej (Fajgenbaum i czerwiec 2020 ).
Fluwoksamina za 30 PLN w ambulatoryjnym leczeniu COVID-19 – badania
https://pulsmedycyny.pl/lek-antydepresyjny-moze-zapobiegac-ciezkiemu-przebiegowi-covid-19-badania-1007905
Gaz Browna – Wodór dla zdrowia: tło, obserwacje i dane medyczne
Budezonid wziewny lek na astmę w wczesnym leczeniu COVID-19 – kto ukrywa te informację ?
Leki i preparaty skuteczne w leczeniu zakażenia wirusem Covid-19.
Originally posted 2021-05-12 14:35:01.
