SARS-CoV-2 oddziałuje z płytkami krwi i megakariocytami poprzez mechanizm niezależny od ACE2
Shu Shen , Jingyuan Zhang , Yaohui Fang , Sihong Lu , Jun Wu , Xin Zheng i Fei Deng Journal of Hematology & Oncology Tom 14 , numer artykułu: 72 ( 2021 )
Od redaktora tekstu:
Kolejne badanie który łączy szczepionki i sposób ich oddziaływania na nasz organizm z powikłaniami po szczepionkach, choć w tekście nie ma o tym jednego słowa.
Jeśli rozumiesz jak działa szczepionka to już wiesz czemu tylu ludzi ma powikłania i tak wielu umiera.
Pełna treść badania wraz z odnośnikami.
Covid – Dowody sugerują, że płytki krwi mogą bezpośrednio oddziaływać z SARS-CoV-2, co budzi obawy, czy receptor ACE2 odgrywa rolę w tej interakcji.
Obecne badanie wykazało, że SARS-CoV-2 oddziałuje zarówno z płytkami krwi, jak i megakariocytami pomimo ograniczonej skuteczności. Obfitość konwencjonalnego receptora ACE2 i alternatywnych receptorów lub kofaktorów wejścia SARS-CoV-2 została scharakteryzowana w płytkach krwi od pacjentów z COVID-19 i osób zdrowych, a także w ludzkich megakariocytach na podstawie testów laboratoryjnych lub wcześniej zgłoszonych danych o sekwencji RNA. Wyniki sugerują, że SARS-CoV-2 oddziałuje z płytkami krwi i megakariocytami poprzez mechanizm niezależny od ACE2 i może regulować alternatywną ekspresję receptorów związaną z zaburzeniami krzepnięcia COVID-19.
W związku z zaburzeniami krzepnięcia, pacjenci z COVID-19 mają zwiększoną aktywację i agregację płytek krwi oraz agregację płytek krwi i monocytów
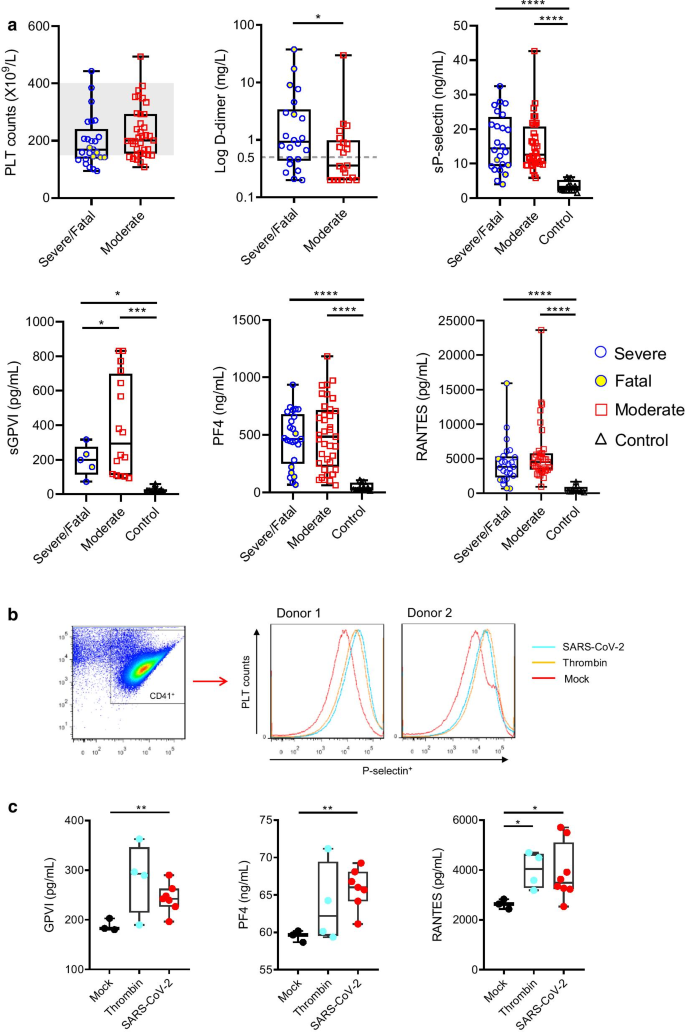
[ 1 , 2 , 3 ], co podkreśla krytyczną rolę płytek krwi w zakażeniu SARS-CoV-2 i immunopatologii [ 4 ]. Zgodnie z wcześniejszymi doniesieniami [ 1 , 2 , 3 ], nasze retrospektywne badanie próbek osocza z kohorty 62 przypadków (pacjentów z ciężkim lub śmiertelnym i umiarkowanym COVID-19, Dodatkowy plik 1: Tabela S1) wykazało, że COVID-19 był powiązany z łagodna małopłytkowość (liczba płytek krwi <150 × 10 9/ L) i zwiększoną zakrzepicę (podwyższone poziomy D-dimerów), a pacjenci mieli zwiększoną aktywację płytek krwi (podwyższone poziomy sP-selektyny i sGPVI) i uwalnianie cytokin (PF4 i RANTES) po aktywacji płytek (ryc. 1 a). Zasugerowano bezpośrednią interakcję SARS-CoV-2 z ludzkimi płytkami krwi na podstawie zwiększonej translokacji selektyny P na powierzchni płytek krwi (ryc. 1 b) i podwyższonych poziomów GPVI, PF4 i RANTES w supernatantach hodowli płytek krwi (ryc. 1 c) . Jednak charakterystyka i mechanizmy bezpośredniej interakcji między SARS-CoV-2 a płytkami krwi nie są dobrze wyjaśnione, a rola receptorów płytkowych w interakcji pozostaje do wyjaśnienia [ 4 , 5 ].Zwiększona aktywacja płytek krwi u pacjentów z COVID-19 i stymulowana przez SARS-CoV-2. a Liczby płytek krwi i poziomy D-dimerów u pacjentów z ciężkim / śmiertelnym i umiarkowanym COVID-19 przedstawiono jako mediany i rozstępy międzykwartylowe. Normalny zakres liczby płytek krwi (150–400 × 10 9 / l) jest zacieniony, a górna wartość graniczna D-dimeru (0,5 mg / l) jest zaznaczona linią przerywaną. Poziomy rozpuszczalnej selektyny P (sP-selektyna), rozpuszczalnego GPVI (sGPVI), PF4 i RANTES w osoczu pacjentów z ciężkim / śmiertelnym lub umiarkowanym COVID-19 i zdrowych kontrolach mierzono za pomocą testu ELISA. bAktywację płytek krwi badano przy użyciu płytek krwi od zdrowych dawców inkubowanych z SARS-CoV-2, trombiną lub pożywką do hodowli wirusów (Mock) przez 3 godziny w 37 ° C. Translokację powierzchniową selektyny P mierzono za pomocą cytometrii przepływowej i przedstawiono wyniki z użyciem płytek krwi od dwóch zdrowych dawców. c Poziomy GPVI, PF4 i RANTES w supernatantach z inkubacji określono za pomocą testu ELISA. *, P <0,05; **, P <0,01; ***, P <0,001; ****, P <0,0001
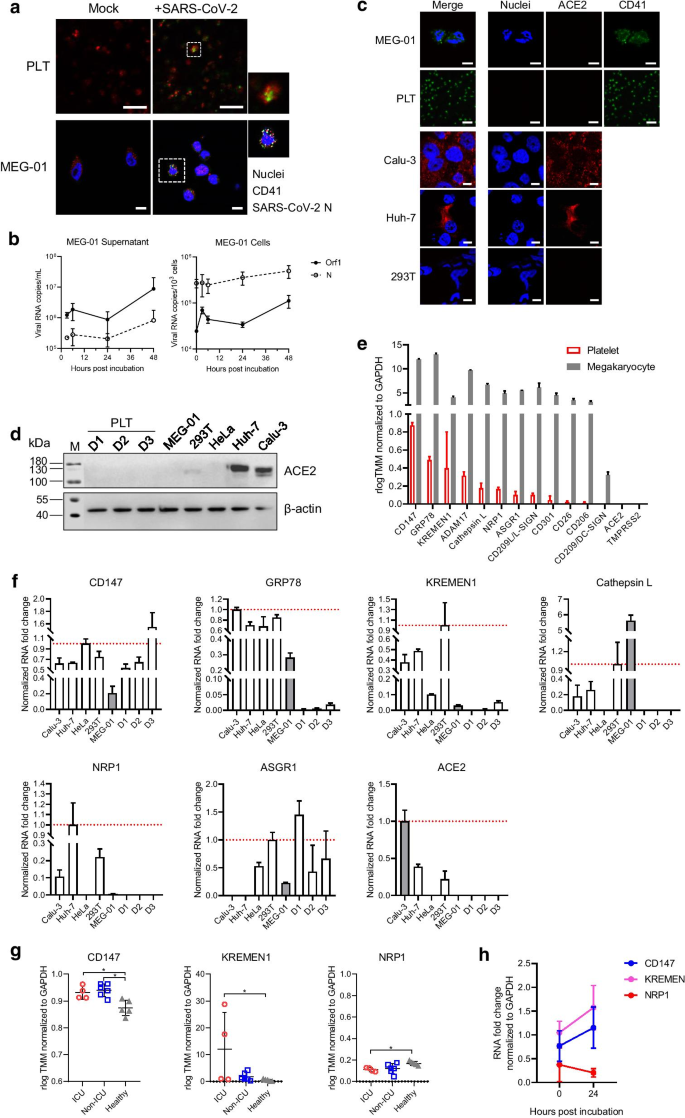
Następnie scharakteryzowano in vitro zakażenie SARS-CoV-2 ludzkich płytek krwi i jej progenitorowych megakariocytów MEG-01. Ekspresję SARS-CoV-2 N obserwowano w niektórych płytkach krwi i komórkach MEG-01 (ryc. 2 a). SARS CoV-2 RNA wykryta zarówno w supernatancie hodowli i Meg-01 komórek po SARS CoV-2 inkubacji i może być utrzymywana w niewielkim wzrostem, aż do 48 h po zakażeniu (Fig. 2 B). Sugeruje to, że SARS-CoV-2 może infekować i replikować się w megakariocytach pomimo niewystarczającej skuteczności. Jednak nie udało nam się zaobserwować żadnych cząstek wirusa w komórkach MEG-01 za pomocą mikroskopii elektronowej, prawdopodobnie z powodu zastosowania niewystarczającej dawki wirusów (1 MOI) do inkubacji lub ograniczonej infekcji w komórkach MEG-01, na co wskazują obrazy IFA. Liczba kopii RNA SARS-CoV-2 była mniejsza w płytkach krwi (10–102 kopii / 10 3 komórek) i supernatant hodowli (10 3 -10 4 kopii / ml), która zmniejsza się po 12 godzinach (dane nie pokazane). Dlatego spekulujemy, że płytki krwi mogą nie obsługiwać replikacji SARS-CoV-2. To echo ostatnich badań, które wykazały, że wejście SARS-CoV-2 do płytek krwi może nie być częste u pacjentów z COVID-19: RNA SARS-CoV-2 wykryto w płytkach krwi z kilku ciężkich (2/25, 8% [ 2 ]) ; 2/11, 18,2% [ 6 ]) i nieciężkich (9/38, 23,7% [ 6 ]) pacjentów i nie był wykrywany w płytkach krwi pacjentów (0/24 [ 7 ]).
Charakterystyka interakcji SARS-CoV-2 z ludzkimi płytkami krwi i megakariocytami. a testy IFA sugerujące zakażenie SARS-CoV-2 płytek krwi i megakariocytów. Płytki krwi od zdrowych dawców i linię komórek megakariocytów MEG-01 inkubowano z SARS-CoV-2 (1 MOI na test). Ekspresję SARS-CoV-2 N w płytkach krwi i komórkach MEG-01 wybarwiono immunologicznie odpowiednio po 3 godzinach po i 24 godzinach po infekcji. b Analiza ilościowa kopii RNA SARS-CoV-2 w supernatantach hodowli i komórkach MEG-01. c Test immunofluorescencyjny ekspresji ACE2 w liniach komórek T MEG-01, płytek krwi (PLT), Calu-3, Huh7 i 293. Słupki, 10 μm. reAnalizy Western blot ekspresji ACE2 w liniach komórkowych, w tym MEG-01, 293 T, HeLa, Huh7 i Calu-3 oraz płytkach krwi (PLT) od trzech zdrowych dawców (D1, D2 i D3).
Ekspresję β-aktyny w komórkach pobrano jako kontrolę wewnętrzną. e transkryptów 14 receptora w ludzkich płytkach krwi i megakariocytów badano za pomocą metod bioinformatycznych wykorzystując dane RNA seq uzyskanych z wcześniejszych badań. faWykrywanie metodą qRT-PCR CD147, GRP78, KREMEN1, katepsyny L, NRP1, ASGR1 i ACE2 w liniach komórkowych, w tym Calu-3, Huh7, HeLa, 293 T i MEG-01 oraz płytek krwi od trzech zdrowych dawców (D1, D2 i D3). Poziomy transkrypcji normalizowano do poziomu GAPDH w każdej odpowiedniej linii komórkowej lub próbkach płytek krwi i porównano z MEG-01 lub Calu-3 (zacienione słupki), jak opisano w Dodatkowym pliku 1: Metody. g Porównanie poziomów RNA CD147, KREMEN1 i NRP1 u pacjentów z OIOM i poza OIT z COVID-19 u osób zdrowych z wykorzystaniem danych RNA-seq uzyskanych z poprzednich badań. h wykrywanie qRT-PCR transkrypcji CD147, KREMEN1 i NRP1 w komórkach MEG-01 po inkubacji z SARS-CoV-2
Covid-19 – Wodór molekularny może także pomóc w walce z długim Covid i rehabilitacji.
Dowody na bezpośrednią interakcję między SARS-CoV-2 a płytkami krwi lub megakariocytami wzbudziły obawy, czy ACE2 odgrywa rolę w tym procesie. Testy IFA i western blot wykazały brak ekspresji ACE2 zarówno w ludzkich płytkach krwi, jak i megakariocytach (ryc. 2 c, d). Liczbę RNA 14 receptorów lub kofaktorów, w tym ACE2, w ludzkich płytkach krwi i megakariocytach zbadano następnie na podstawie danych RNA-seq zgłoszonych w poprzednich badaniach [ 2 , 8 ] (Dodatkowy plik 1: Tabela S2 i S3). Jak przedstawiono na Fig. 2e, kolejność występowania w płytkach była następująca: CD147> GRP78> KREMEN1> ADAM17> katepsyna L> NRP1> ASGR1> CD209L / L-SIGN> CD301> CD26> CD206, ale nie zidentyfikowano CD209 / DC-SIGN, ACE2 i TMPRSS2 .
Ludzkie megakariocyty miały podobne profile receptorów, w połączeniu z wykrywaniem CD209 / DC-SIGN. Zweryfikowaliśmy również obfitość receptorów w MEG-01 i ludzkich płytkach krwi za pomocą qRT-PCR. W komórkach MEG-01 wykryto CD147, GRP78, KREMEN1, katepsynę L, NRP1 i ASGR1, podczas gdy w płytkach krwi wykryto CD147, GRP78, KREMEN1 i ASGR1. ACE2 nie został wykryty w komórkach MEG-01 ani w płytkach krwi (ryc. 2 f). Wyniki te wskazują, że SARS-CoV-2 może wykorzystywać receptory inne niż ACE2 do interakcji z płytkami krwi lub megakariocytami.
Dalsza analiza z wykorzystaniem danych RNA-seq wykazała niezmienione GRP78, ADAM1, katepsyny L, GRP1 i ASGR1 obfitość w płytkach krwi pomiędzy pacjentami z OIT-19 i nie-OIT oraz osobami zdrowymi i ujawniła podwyższone poziomy CD147 i KREMEN1 oraz obniżone poziomy NRP1 u pacjentów (Ryc. 2 g). Zaobserwowano to również w komórkach MEG-01 ze zwiększonymi poziomami CD147 i KREMEN1 i nieznacznie obniżonymi poziomami NRP1 po inkubacji z SARS-CoV-2 (Rys. 2 h). Dane te sugerują, że zakażenie SARS-CoV-2 może zmienić transkrypcję genów w płytkach krwi i megakariocytach, co jest podobne do zakażenia DENV, które znacząco zmienia transkryptom płytek i megakariocytów [ 8 ].
Ze względu na ich rolę w wiązaniu się z białkiem wypustek i ułatwianiu wnikania wirusa [ 9 , 10 , 11 ], wyzwalanie wejścia SARS-CoV-2 do ludzkich płytek krwi i megakariocytów, CD147, KREMEN1 i NRP1 [ 9 , 10 , 11 ] wymaga pogłębionych badań. Ponadto, w oparciu o pierwotne funkcje CD147 w szlakach sygnałowych poprzez interakcje komórka-komórka [ 9 ] oraz NRP1 w układzie sercowo-naczyniowym, neuronalnym i immunologicznym [ 10 ], podejrzewa się, że interakcja SARS-CoV-2 z płytkami krwi reguluje odpowiedzi immunologicznej [ 12 ] i promują zaburzenia krzepnięcia w COVID-19 [ 10 ].
Dostępność danych i materiałów
Wszystkie dane wygenerowane lub przeanalizowane podczas tego badania są zawarte w tym opublikowanym artykule (i jego dodatkowych plikach informacyjnych)
- Bibliografia
- 1.
Hottz ED, Azevedo-Quintanilha IG, Palhinha L, Teixeira L, Barreto EA, Pão CRR, et al. Aktywacja płytek krwi i tworzenie agregatów płytek krwi i monocytów wyzwalają ekspresję czynnika tkankowego u pacjentów z ciężkim COVID-19. Krew. 2020; 136: 1330–41.
- 2.
Manne BK, Denorme F, Middleton EA, Portier I, Rowley JW, Stubben CJ i wsp. Ekspresja i funkcja genów płytek krwi u pacjentów z COVID-19. Krew. 2020; 136: 1317–29.
- 3.
Middleton EA, He XY, Denorme F, Campbell RA, Ng D, Salvatore SP, i wsp. Neutrophil extracellulartraps (NET) przyczyniają się do zakrzepicy immunologicznej w zespole ostrej niewydolności oddechowej COVID-19. Krew. 2020; 136: 1169–79.
- 4.
Koupenova M, Freedman JE. Płytki krwi i COVID-19: Zapalenie, hiperaktywacja i dodatkowe pytania. Circ Res. 2020; 127 (11): 1419–21.
- 5.
Campbell RA, Boilard E, Rondina MT. Czy receptor ACE2 odgrywa rolę w interakcjach SARS-CoV-2 z płytkami krwi? J Thromb Haemost. 2021; 19 (1): 46–50.
- 6.
Zaid Y, Puhm F, Allaeys I, Naya A, Oudghiri M, Khalki L, i wsp. Płytki krwi mogą wiązać się z RNA SARS-Cov-2 i są hiperaktywowane w COVID-19. Circ Res. 2020; 127 (11): 1404–18.
- 7.
Bury L, Camilloni B, Castronari R, Piselli E, Malvestiti M, Borghi M, i wsp. Wyszukaj RNA SARS-CoV-2 w płytkach krwi od pacjentów z COVID-19. Płytki krwi. 2021; 32 (2): 284–7.
- 8.
Campbell RA, Schwertz H, Hottz ED, Rowley JW, Manne BK, Washington AV i wsp. Ludzkie megakariocyty posiadają wewnętrzną odporność przeciwwirusową poprzez regulowaną indukcję IFITM3. Krew. 2019; 133 (19): 2013–26.
- 9.
Wang K, Chen W, Zhang Z, Deng Y, Lian JQ, Du P, i wsp. Białko CD147-spike to nowa droga zakażenia SARS-CoV-2 do komórek gospodarza. Signal Transduct Target Ther. 2020; 5 (1): 283.
- 10.
Mayi BS, Leibowitz JA, Woods AT, Ammon KA, Liu AE, Raja A.Rola Neuropilin-1 w COVID-19. PLOS Pathog. 2021; 17 (1): e1009153.
- 11.
Gu Y, Cao J, Zhang X, Gao H, Wang Y, Wang J, i wsp. Sieć interakcji SARS-CoV-2 z receptomem gospodarza poprzez białko wypustkowe. bioRxiv-Microbiol; 2020. https://doi.org/10.1101/2020.09.09.287508
- 12.
Savla SR, Prabhavalkar KS, Bhatt LK. Powikłania krzepnięcia związane z burzą cytokinową u pacjentów z COVID-19: Patogeneza i zarządzanie. Expert Rev Anti Infect Ther. 2021. https://doi.org/10.1080/14787210.2021.1915129 .
Gaz Browna – Wodór dla zdrowia: tło, obserwacje i dane medyczne
Suplementacja cynku wzmacnia zastosowanie leków przeciwwirusowych przeciwko SARS-CoV-2
Amantadyna, ketamina i magnez w leczeniu COVID-19 – autorski projekt dr. hab. Cezarego Pakulskiego
Originally posted 2021-05-03 21:46:20.