NA skróty cytuje:
Tak więc odzyskani pacjenci z COVID-19 prawdopodobnie lepiej bronią się przed wariantami niż osoby, które nie zostały zakażone, ale zostały zaszczepione tylko szczepionkami zawierającymi kolce.
Nasze odkrycia pokazują, że większość pacjentów z COVID-19 indukuje szeroko zakrojoną obronę immunologiczną przeciwko infekcji SARS-CoV-2, obejmującą przeciwciała i limfocyty B pamięci rozpoznające zarówno RBD, jak i inne regiony kolca, szeroko specyficzne i wielofunkcyjne limfocyty T CD4+, i wielofunkcyjne limfocyty T CD8+. Odpowiedź immunologiczna na naturalną infekcję z dużym prawdopodobieństwem zapewni ochronną odporność nawet przeciwko wariantom SARS-CoV-2, ponieważ epitopy komórek T CD4+ i CD8+ zostaną zachowane.
Od redaktora:
Z innych badań publikowanych kilka dni temu w tym serwisie jasno wynika, że taka naturalna ochrona utrzymuje się prawdopodobnie do końca życia
Od redaktora:
Reasumując każdy ozdrowieniec idący się szczepić niepotrzebnie ryzykuje swoim życiem i zdrowiem, co potwierdzają politycy wydając ozdrowieńcom tak zwane paszporty szczepionkowe.
Ci sami Politycy i psedo lekarze i pseudo profesorowie z rady eugenicznej namawiają jednak ozdrowieńców do szczepień, co biorąc pod uwagę ryzyko powikłań po niepotrzebnym szczepieniu dla mnie jest usiłowaniem morderstwa na polskich obywatelach.
Całość badania!
STRESZCZENIE
Zakończenie pandemii COVID-19 będzie wymagało długotrwałej odporności na SARS-CoV-2. Oceniliśmy 254 pacjentów z COVID-19 od wczesnej infekcji i przez osiem miesięcy później i znaleźliśmy dominującą odpowiedź pamięci immunologicznej o szerokiej podstawie. Wiążące i neutralizujące przeciwciała SARS-CoV-2 wykazywały dwufazowy zanik z wydłużonym okresem półtrwania >200 dni, co sugeruje wytwarzanie dłużej żyjących komórek plazmatycznych. Ponadto wystąpiła utrzymująca się odpowiedź komórek B pamięci IgG+, co dobrze wróży szybkiej odpowiedzi przeciwciał po ponownej ekspozycji wirusa. Wytworzono także wielofunkcyjne limfocyty T CD4+ i CD8+ swoiste wobec wirusa i utrzymywano je z szacowanym okresem półtrwania wynoszącym 200 dni. Co ciekawe, odpowiedź limfocytów T CD4+ w równym stopniu ukierunkowana była na kilka białek SARS-CoV-2, podczas gdy odpowiedź limfocytów T CD8+ była preferencyjnie ukierunkowana na nukleoproteinę, podkreślając znaczenie włączenia nukleoproteiny jako potencjalnego antygenu szczepionkowego. Podsumowując, wyniki te sugerują, że szeroka i skuteczna odporność może utrzymywać się długoterminowo u pacjentów z COVID-19, którzy wyzdrowieli.
WPROWADZENIE
Pandemia COVID-19 spowodowana szybkim rozprzestrzenianiem się SARS-CoV-2, nowego betakoronawirusa, nadal powoduje znaczną zachorowalność i śmiertelność. Indukcja skutecznej wczesnej kontroli immunologicznej SARS-CoV-2 i trwałej pamięci immunologicznej mają kluczowe znaczenie dla zapobiegania ciężkiej chorobie i ochrony przed ponownym narażeniem. Zakażenie SARS-CoV-2 indukuje poliklonalne odpowiedzi humoralne i komórkowe skierowane na wiele białek wirusowych opisanych w badaniach przekrojowych i podłużnych ( Sette i Crotty, 2021). Bardziej kompleksowe, ilościowe analizy z obszernym seryjnym pobieraniem próbek od większej liczby pacjentów z COVID-19 są ograniczone i mogą rozwiązać niektóre sprzeczne poglądy na temat trwałości odporności humoralnej. Co ważne, zdefiniowanie częstotliwości, funkcji immunologicznej i swoistości przeciwciał, odpowiedzi komórek B i T pamięci wśród pacjentów z COVID-19 oraz określenie, kiedy się pojawiają i jak długo się utrzymują, może zapewnić zrozumienie integralnych elementów długotrwałej odporności na SARS -CoV-2 i potencjalnie inne ludzkie koronawirusy, które pojawią się w przyszłości ( Stephens i McElrath, 2020 ).
Zainicjowaliśmy dwie potencjalne kohorty pacjentów z COVID-19 w Seattle i Atlancie podczas pierwszej fali pandemii, aby zbadać długoterminową odporność na SARS-CoV-2. Wśród 254 pacjentów z COVID-19 włączonych i często pobieranych, identyfikujemy przeciwciała wiążące i neutralizujące przeciwko SARS-CoV-2, a także limfocyty B i T swoiste dla antygenu, wywołane wcześnie po zakażeniu, określamy ich specyficzność, określamy ilościowo stopień wzmocnienia przeciwciał krzyżowych -reaktywne odpowiedzi na inne koronawirusy i dalej scharakteryzować szybkość zaniku i trwałość tych parametrów odpornościowych w ciągu 250 dni. Stosujemy wysoce wystandaryzowane lub zwalidowane testy, które są również wykorzystywane do oceny odporności w ostatnich i trwających badaniach klinicznych szczepionek ( Anderson i wsp., 2020 ; Doria-Rose i wsp., 2021 ;Sadoff i in., 2021 ). To dogłębne badanie podłużne pokazuje, że trwała pamięć immunologiczna utrzymuje się u większości pacjentów z COVID-19, w tym u pacjentów z łagodną chorobą, i służy jako podstawa do zdefiniowania i przewidywania długotrwałej odporności na SARS-CoV-2 po naturalnej infekcji. Badanie to posłuży również jako punkt odniesienia dla pamięci immunologicznej indukowanej u ludzi przez szczepionki SARS-CoV-2.
WYNIKI
Populacja badania COVID-19-19
Leki i preparaty skuteczne w leczeniu zakażenia wirusem Covid-19.
Pacjenci z potwierdzeniem COVID-19 zostali zrekrutowani do naszego długoterminowego badania pamięci komórek B i T swoistej dla SARS-CoV-2 po zakażeniu. W sumie 254 pacjentów zarejestrowano w dwóch ośrodkach, w Atlancie i Seattle, począwszy od kwietnia 2020 r. i wróciło na wizyty kontrolne przez okres 250 dni. Udało nam się pobrać próbki krwi w 2-3 punktach czasowych od 165 pacjentów oraz w 4-7 punktach czasowych od kolejnych 80 pacjentów, co pozwoliło nam na przeprowadzenie analizy podłużnej odpowiedzi limfocytów B i T specyficznych dla SARS-CoV-2 na duża liczba zakażonych pacjentów. Dane demograficzne i wyjściową charakterystykę tej kohorty opisano w Tabeli S1. Grupa badana składała się z 55% kobiet i 45% mężczyzn w wieku 18-82 lat (mediana 48,5 roku). W oparciu o wytyczne Światowej Organizacji Zdrowia (WHO) dotyczące nasilenia choroby, 71% uczestników badania wykazywało łagodną chorobę,
Odpowiedzi przeciwciał na białko szczytowe SARS-CoV-2 wykazują dwufazowy rozpad z wydłużonym okresem półtrwania
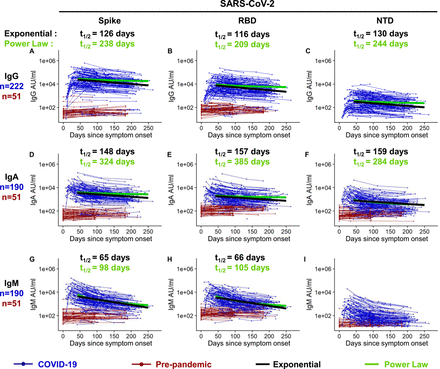
Przeciwciała wiążące SARS-CoV-2 pełnej długości białka wypustek, domeny wiążącej receptor (RBD) i domeny N-końcowej (NTD) białka wypustek oceniano u pacjentów z COVID-19 (n=222) przez okres 8 miesięcy po wystąpieniu objawów. Uwzględniliśmy zdrowe osoby w wieku 18-42 lat jako kontrole negatywne, których podłużne próbki krwi pobrano przed wystąpieniem pandemii COVID-19. Te próbki przed pandemią (n=51) pochodziły od biorców sezonowej inaktywowanej szczepionki przeciw grypie (n=27, pobranej w latach 2014-2018) lub żywej szczepionki przeciwko żółtej gorączce (YFV-17D) (n=24, pobranej z 2005-2007). Test Mesoscale multiplex zastosowano do pomiaru odpowiedzi przeciwciał IgG, IgA i IgM na białka SARS-CoV-2 u pacjentów z COVID-19 i zdrowych kontroli przed pandemią.
Wielkość przeciwciał IgG w surowicy wiążących się z białkiem wypustkowym SARS-CoV-2 wzrosła u 92% uczestników rekonwalescencji COVID-19 (n=222) w stosunku do kontroli przed pandemią ( Figura 1A ). Odpowiedzi IgG na skok SARS-CoV-2, RBD i NTD zmniejszały się z czasem z okresami półtrwania wynoszącymi 126 (95% przedział ufności [95% CI] [107, 154]), 116 (95% CI [97, 144 ]) i 130 (95% CI [110, 158]) odpowiednio dni, jak oszacowano za pomocą modelu zaniku wykładniczego ( Rysunek 1A-Ci S1A). Oszacowaliśmy również zanik przeciwciał za pomocą modelu prawa potęgowego, który modeluje scenariusz, w którym tempo rozpadu przeciwciał zmniejsza się w czasie. Model prawa mocy wytworzył lepsze dopasowanie do rozpadu przeciwciał IgG wiążących SARS-CoV-2, RBD i NTD (ΔAIC>10), co sugeruje, że przeciwciała swoiste dla piku stabilizują się w czasie. Ponieważ szybkość rozpadu zmienia się w czasie, przewiduje się, że okres półtrwania również zmieni się w czasie; dlatego użyliśmy modelu prawa potęgowego, aby oszacować okresy półtrwania po 120 dniach od wystąpienia objawów. Prawo potęgowe oszacowało okresy półtrwania dla odpowiedzi przeciwciał IgG na skok (t 1/2 = 238 dni), RBD (t 1/2 = 209 dni) i NTD (t 1/2=244 dni) były dłuższe niż te oszacowane przez model zaniku wykładniczego (Figura S1A, C), co wskazuje, że stężenie tych przeciwciał IgG może zacząć się stabilizować. Przeciwciała IgA ( Rysunek 1D-F ) i IgM ( Rysunek 1G-I ) reagujące na skok SARS-CoV-2 również wzrosły po zakażeniu SARS-CoV-2, ale zostały wykryte na niższych poziomach i spadały szybciej niż SARS-CoV-2 -reaktywne przeciwciała IgG. Zgodnie z oczekiwaniami, IgM wiążące kolce zanikały szybciej niż wiążące kolce IgA i IgG. Podsumowując, wyniki te pokazują, że odpowiedzi przeciwciał, zwłaszcza przeciwciał IgG, były nie tylko trwałe u ogromnej większości pacjentów w okresie 250 dni, ale także, że dwufazowa krzywa zaniku sugeruje wytwarzanie dłużej żyjących komórek plazmatycznych wytwarzających przeciwciała przeciwko SARS -Białko kolce CoV-2.
Rysunek 1.Wzdłużne odpowiedzi przeciwciał wiążących wypustki SARS-CoV-2.
przeciwciała IgG (AC), IgA (DF) i IgM (GI) reagujące na wypustkę SARS-CoV-2 (A, D, G), domenę wiążącą receptor kolca (RBD; B, E, H) i wypust N domenę końcową (NTD; C, F, I) zmierzono elektrochemiluminescencyjnym multipleksowym testem immunologicznym i podano jako jednostki arbitralne na ml (AU/ml) znormalizowane za pomocą krzywej standardowej. Wzdłużne miana przeciwciał u pacjentów z COVID-19 (na niebiesko, n=222 COVID-19+ dla IgG; n=190 COVID-19+ dla IgA i IgM) wykreślono na przestrzeni dni od wystąpienia objawów, podczas gdy próbki od dawców przed pandemią (na czerwono, n=51 dla IgG, IgA i IgM) zebrano w trakcie badania szczepionek nie-SARS-CoV-2 przed 2019 r. i wykreślono w dniach od immunizacji. Krzywe zaniku IgG i okresy półtrwania oszacowane za pomocą wykładniczego modelu zaniku przedstawiono na czarno,
Zbadaliśmy również odpowiedź przeciwciał na białko nukleokapsydu SARS-CoV-2 u tych zakażonych pacjentów. Zgodnie z oczekiwaniami pacjenci z COVID-19 wykazywali wyższy poziom przeciwciał przeciwko białku nukleokapsydu w porównaniu ze zdrowymi kontrolami przed pandemią (rysunek S2). Jednakże poziom przeciwciał swoistych dla nukleokapsydu zmniejszył się ze znacznie krótszym okresem półtrwania wynoszącym 63 dni (95%CI [58, 70]) w porównaniu z przeciwciałami przeciwko białku wypustek (Figura S1A, C). Ponadto, szybkość rozpadu IgG reaktywnych względem nukleokapsydu była najlepiej dopasowana w modelu wykładniczym, a nie w modelu mocy, w przeciwieństwie do tego, co zaobserwowaliśmy z szybkością rozpadu przeciwciał IgG o wysokim skoku (rysunek S1A). A zatem,
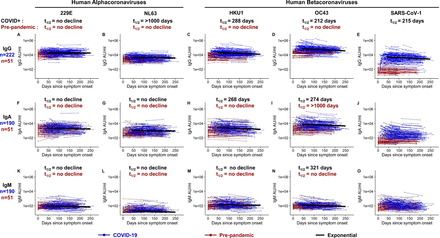
Stabilna i długowieczna odpowiedź przeciwciał na powszechne ludzkie alfa- i betakoronawirusy w zdrowych kontrolach przed pandemią
Byliśmy zainteresowani ustaleniem, czy infekcja SARS-CoV-2 miała jakikolwiek wpływ na poziom przeciwciał przeciwko krążącym ludzkim alfa- i betakoronawirusom. Jako wstęp do tego pytania, najpierw zbadaliśmy poziomy przeciwciał przeciwko białku wypustkowemu dwóch krążących alfakoronawirusów (229E i NL63) oraz dwóch betakoronawirusów (HKU1 i OC43) w naszych próbkach przed pandemią. Jak pokazano na Figurze 2 , wszystkie 51 próbek przed pandemią miało wyraźnie wykrywalne poziomy przeciwciał IgG i IgA wobec białek wypustek czterech ludzkich koronawirusów. Jest to oczekiwany wynik, ponieważ seropozytywność wobec tych koronawirusów jest bardzo wysoka w dorosłej populacji. Ale dość interesująca była niezwykła stabilność tych odpowiedzi przeciwciał w okresie 200 dni w próbkach surowicy przed pandemią (pokazana jako czerwone linie wFigura 2 ). Były to zasadniczo płaskie linie bez spadku poziomu przeciwciał i kwestionują dominujące przekonanie, że odpowiedzi przeciwciał na endemiczne koronawirusy są krótkotrwałe ( Callow i wsp., 1990 ; Edridge i wsp., 2020 ; Lavine i wsp., 2021 ). . Chociaż nie można wykluczyć okazjonalnego wzmocnienia tych zakażeń koronawirusem nabytych w dzieciństwie, te dane pokazujące tak stabilne miana przeciwciał najlepiej można wyjaśnić utrzymywaniem się długo żyjących komórek plazmatycznych w szpiku kostnym wiele lat po zakażeniu ( Amanna i wsp., 2007 ; Davis et al, 2020. ; . Hammarlund et al, 2003 ; . Manz et al, 1997 ; Slifka et al., 1998 ).
Rysunek 2.Odpowiedzi przeciwciał wiążących wzdłużnie na inne białka wypustek koronawirusa.
Odpowiedzi przeciwciał IgG (AE), IgA (FJ) i IgM (KO) w surowicach pobranych od pacjentów z COVID-19+ (na niebiesko, n=222 dla IgG; n=190 dla IgA i IgM) i dawców przed pandemią ( na czerwono, n=51 dla IgG, IgA i IgM), które były reaktywne na wypustkę 229E (A, F, K), wypustkę NL63 (B, G, L), wypustkę HKU1 (C, H, M), wypustkę OC43 ( D, I, N) i białko wypustek SARS-CoV-1 (E, J, O). Odpowiedzi przeciwciał mierzono elektrochemiluminescencyjnym multipleksowym testem immunologicznym i przedstawiano jako jednostki arbitralne na ml (AU/ml) znormalizowane za pomocą krzywej standardowej. Krzywe zaniku IgG i okresy półtrwania oszacowane na podstawie wykładniczego modelu zaniku pokazano na czarno. W próbkach pobranych od zdrowych dawców przed pandemią nie stwierdzono znaczącego spadku IgG reaktywnych na endemiczne alfa i betakoronawirusy (czerwony, AD).
Zakażenie COVID-19 powoduje wzrost poziomu przeciwciał przeciwko dwóm powszechnym ludzkim betakoronawirusom (HKU1 i OC43) oraz SARS-CoV-1
Następnie zbadaliśmy, czy infekcja SARS-CoV-2 miała jakikolwiek wpływ na poziomy przeciwciał przeciwko innym ludzkim koronawirusom. Zmierzyliśmy wiązanie przeciwciał IgG, IgA i IgM z białkami wypustek innych znanych ludzkich koronawirusów u pacjentów z COVID-19 (n=222 dla IgG i n=190 dla IgA i IgM) i porównaliśmy te dane z 51 przed pandemią. próbki od zdrowych dawców. U pacjentów z COVID-19 przeciwciała IgG i IgA przeciwko alfakoronawirusom, 229E i NL63, nie wykazały żadnych znaczących zmian w porównaniu z poziomami przeciwciał w zdrowych kontrolach przed pandemią ( Rysunek 2A , B, F, G; Rysunek S1C, RE). W przeciwieństwie do tego, przeciwciała IgG i IgA przeciwko betakoronawirusom HKU1 i OC43 były znacznie podwyższone u pacjentów z COVID-19 w porównaniu z kontrolami przed pandemią ( Rysunek 2C, D, H, I; Rysunek S1C, D; p<0,0001). Po tej dawce przypominającej poziomy przeciwciał IgG HKU1 i OC43 spadły z szacowanym okresem półtrwania wynoszącym odpowiednio 288 (95%CI [235, 372]) i 212 (95%CI [176, 268]) dni (model zaniku wykładniczego). Poziomy IgM dla powszechnych betakoronawirusów HKU1 i OC43 były niskie zarówno w grupie kontrolnej przed pandemią, jak iu pacjentów z COVID-19 ( Rysunek 2M, N). Chociaż istniejąca wcześniej ekspozycja i przeciwciała przeciwko betakoronawirusom HKU1 i OC43 są powszechne u dorosłych, wcześniejsza ekspozycja na SARS-CoV-1 jest rzadka, a poziomy przeciwciał przeciwko białku wypustkowemu SARS-CoV-1 były bardzo niskie (zasadniczo ujemne) w okresie przed- zdrowe kontrole pandemiczne. Jednak poziom przeciwciał reagujących na kolce SARS-CoV-1 znacznie wzrósł po zakażeniu SARS-CoV-2. Wzrosty te były dość uderzające dla IgG (p=0,0038), a także IgA (p=0,0084) i najprawdopodobniej reprezentują reaktywne krzyżowo przeciwciała skierowane przeciwko epitopom kolców SARS-CoV-2, które są konserwowane między SARS-CoV-2 i SARS CoV- 1 (Ellis i in., 2021). Te nowo indukowane krzyżowo reaktywne przeciwciała IgG wytworzone po zakażeniu COVID-19 zmniejszyły się z szacowanym okresem półtrwania wynoszącym 215 dni (95% CI [168, 298]) (model zaniku wykładniczego) ( Figura 2). Podsumowując, wyniki te pokazują, że osoby zakażone SARS-CoV-2 mogą mieć również podwyższoną odporność na powszechne ludzkie betakoronawirusy i, co ważniejsze, na SARS-CoV-1.
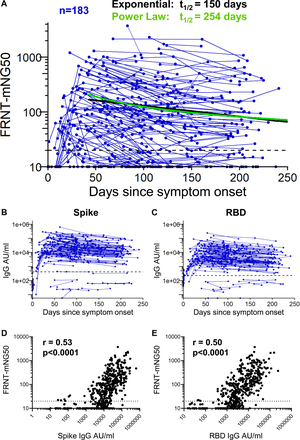
Trwałe odpowiedzi przeciwciał neutralizujących na SARS-CoV-2 u zakażonych pacjentów
Przeciwciała neutralizujące mierzono testem neutralizacji redukcji ognisk żywego wirusa, który wykorzystuje rekombinowany wirus SARS-CoV-2 eksprymujący fluorescencyjny gen reporterowy mNeonGreen (FRNT-mNG) ( Figura 3A ). W ciągu pierwszych 250 dni po wystąpieniu objawów miana FRNT 50 różniły się znacznie u poszczególnych osób i mieściły się w zakresie od <20 do 3726 ( ryc. 3A). Spośród 183 osób, u których oznaczono miana neutralizacji podłużnej, 140 (77%) miało co najmniej jeden punkt czasowy z mianami neutralizacji powyżej granicy wykrywalności (>20). Siedemdziesiąt pięć procent (43/57) pacjentów z COVID-19 wytworzyło przeciwciała neutralizujące surowicę w ciągu 30-50 dni od wystąpienia objawów, podobnie 72% (48/67) miało mierzalne miana między 180-263 dniami po wystąpieniu objawów. Stosując model zaniku wykładniczego, oceniliśmy kinetykę miana przeciwciał neutralizujących po 42 dniu i oszacowaliśmy okres półtrwania na 150 dni (95% CI [124, 226]). Jednakże, podobnie jak w przypadku przeciwciał IgG wiążących reaktywne kolce, postawiliśmy hipotezę, że tempo rozpadu przeciwciał neutralizujących może w rzeczywistości spowolnić w czasie w okresie zdrowienia. Aby temu zaradzić, do danych dopasowujemy prawo energetyczne.
Rysunek 3.Neutralizujące odpowiedzi przeciwciał na SARS-CoV-2
(A) Miana przeciwciał neutralizujących w surowicy in vitro przeciwko SAR-CoV-2 zmierzono w teście neutralizacji redukcji ogniska u 183 pacjentów z COVID-19. Granica wykrywalności jest oznaczona linią przerywaną przy FRNT-mNG 50= 20. Okres półtrwania oszacowany za pomocą modelu zaniku wykładniczego (kolor czarny) wynosi 150 dni, podczas gdy okres półtrwania oszacowany na dzień 120 za pomocą modelu prawa potęgowego (kolor zielony) wynosi 254 dni. Miana przeciwciał IgG reagujących na skok SARS-CoV-2 (B) i RBD (C) dopasowanego 183 COVID-19, dla którego oceniono miana neutralizacji. Średnia geometryczna miana plus 3 odchylenia standardowe próbek przed pandemią wskazano linią przerywaną (B i C). Poziomy IgG reaktywnych wobec SARS-CoV-2 (D) i RBD (E) korelowały z mianami neutralizacji w dopasowanym punkcie czasowym (korelacja z powtarzanymi pomiarami, p<0,0001). Granica wykrywalności jest wskazana linią przerywaną przy FRNT-mNG 50 = 20.
Następnie oceniliśmy związek między poziomami przeciwciał wyskokowych i wiążących RBD a neutralizacją SARS-CoV-2. Figury 3B i C przedstawiają kinetykę odpowiedzi wyskoku SARS-CoV-2 i przeciwciała wiążącego RBD u 183 uczestników, u których oceniono miana neutralizacji. Wykazywały one szeroki zakres poziomów wiązania przeciwciał, od pacjentów nieodpowiadających na 3 odchylenia standardowe, patrz linia przerywana na Figurze 3B , C) do tych z poziomami IgG >200 000 AU/ml. Poziomy IgG wiążących skoki i RBD korelowały istotnie z mianami neutralizacji ( Figura 3D , E; p<0,0001).
Podsumowując, nasze odkrycia pokazują, że indukcja przeciwciał neutralizujących występuje u większości pacjentów z COVID-19. Te przeciwciała neutralizujące mogą utrzymywać się przez okres 8-9 miesięcy po zakażeniu i wykazują korelację z IgG wiążącym się z wyskokiem i RBD.
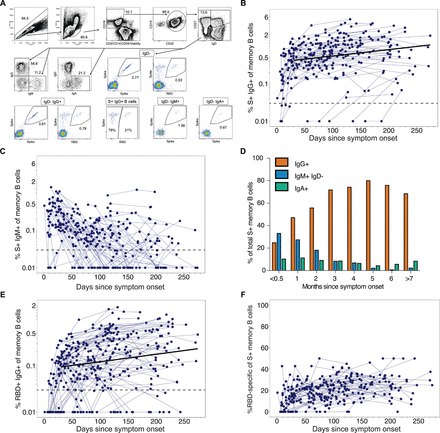
Skok SARS-CoV-2 i komórki B pamięci specyficzne dla RBD wzrastają przez kilka miesięcy po zakażeniu, a następnie przez 8 miesięcy
Komórki pamięci B (MBC) są ważnym składnikiem odporności humoralnej i przyczyniają się do kontroli wirusa poprzez generowanie odpowiedzi przeciwciał po ponownej ekspozycji na patogen. Zastosowaliśmy pełnej długości sondy wypustek i antygenu RBD do ilościowego określenia częstości występowania MBC swoistych dla wypustek SARS-CoV-2 i RBD w próbkach PBMC od 111 pacjentów z COVID-19 ( ryc. 4 ) i 29 kontroli przed pandemią (ryc. S3A, B). Nasza strategia bramkowania cytometrii przepływowej w celu identyfikacji MBC specyficznych dla SARS-CoV-2 i klasyfikacji ich jako izotypów IgG, IgM i IgA MBC jest pokazana na Figurze 4A .
Rysunek 4.Skok SARS-CoV-2 i komórki B pamięci specyficzne dla RBD.
(A) Reprezentatywna strategia bramkowania komórek B pamięci jest pokazana w celu identyfikacji piku SARS-CoV-2 i komórek B pamięci IgD-IgG+, IgD-IgM+ i IgD-IgA+ specyficznych dla RBD w komórkach PBMC od uczestnika SARS-CoV-2 ozdrowiałego. Częstotliwość limfocytów B pamięci typu spike+ (B) IgG+ i (C) IgM+ poza limfocytami B pamięci (IgD-CD19+ CD20+) jest wyświetlana w czasie od wystąpienia pierwszych objawów wśród osób zakażonych SARS-CoV-2 (n=105 osób). Linia przerywana wskazuje granicę wykrywalności. Pogrubiona linia przedstawia medianę dopasowanej krzywej z liniowego modelu efektów mieszanych odpowiedzi po 30 dniach. (D) Średni procent komórek B pamięci typu spike+ wyrażających izotypy IgG, IgM lub IgA oceniano w miesięcznych odstępach po wystąpieniu objawów. (E) Częstotliwość RBD+ IgG+ komórek B pamięci w czasie (n=141).
Wśród całkowitego MBC, skokowe poziomy IgG+ MBC były istotnie zwiększone u pacjentów z COVID-19 (n=111; Ryc. 4B ) w porównaniu do kontroli przed pandemią (n=29; Ryc. S3A) (mediana wzrostu, 0,73% w porównaniu z 0,02% p<0,0001). Po gwałtownej wczesnej ekspansji w ciągu pierwszych 2-3 miesięcy, skok IgG+ MBC utrzymywał się u pacjentów z COVID-19 bez spadku do 250 dni po wystąpieniu objawów. Te ustalenia ( Figura 4B ) są poparte dodatnim nachyleniem (0,004) z modelu odpowiedzi podłużnego piku IgG+ MBC po 30 dniu (95% CI [0,002, 0,006], p<0,001; Figury S4A, B).
Iglica IgM+ MBC pojawiła się w ciągu pierwszych dwóch tygodni po wystąpieniu objawów i szybko zmalała ( Figura 4C , D). Zanik kontynuował po 30 dniu (nachylenie=-0,007, 95%CI [-0,010, -0,005], p<0,001). Miesiąc po wystąpieniu objawów, 56% kolca MBC stanowiły IgG+, które wzrosły do szczytu 80% po 5-6 miesiącach ( Figura 4D ). Krążące kolce IgA+ MBC były również wykrywalne u wielu pacjentów przy niskich częstotliwościach i bez znaczących zmian w czasie (dzień 30 do 250: nachylenie=0,000, 95% CI [-0,002, 0,002], p=0,91, Figura 4D ).
Ponieważ RBD zawiera pierwotne epitopy neutralizujące na kolcu, użyliśmy również sondy specyficznej dla RBD, aby scharakteryzować ten podzbiór komórek B pamięci specyficznych dla kolca. Ogólnie, około 20% komórek B pamięci z kolcami IgG+ kierowało się na RBD, co było spójne dla osobników i czasu ( Figura 4E , F). Zgodnie z oczekiwaniami, RBD+ IgM+ MBC pojawiły się na wczesnym etapie infekcji, a następnie przeszły na RBD+ IgG+ MBC, które stopniowo wzrastały podczas obserwacji (dzień 30 do 250: nachylenie=0,004, 95%CI [0,002, 0,005], p<0,001, Rycina 4E ). Zatem utrzymanie krążących komórek B pamięci IgG swoistych dla kolca i RBD sugeruje, że komórki te mogą być rekrutowane do szybkiej odpowiedzi wtórnej po ponownym narażeniu lub po szczepieniu.
Indukcja trwałych i wielofunkcyjnych limfocytów T CD4+ i CD8+ specyficznych dla wirusa u zakażonych pacjentów
Limfocyty T CD4+ mają kluczowe znaczenie dla wytwarzania odpowiedzi przeciwciał o wysokim powinowactwie i mogą również mieć działanie przeciwwirusowe. Ponadto zapewniają pomoc w odpowiedzi limfocytów T CD8+, które są niezbędne do zabijania zakażonych komórek i pośredniczenia w usuwaniu wirusa. W związku z tym, następnie zbadaliśmy odpowiedzi limfocytów T CD4+ i CD8+ specyficzne względem wirusa wzdłużnie u pacjentów z COVID-19 i niezakażonych kontroli przy użyciu wielowymiarowego, wieloparametrowego badania ex vivo.test barwienia wewnątrzkomórkowych cytokin (ICS). Test jest czuły, precyzyjny i specyficzny do wykrywania komórek T specyficznych wobec antygenu, wyrażających wiele cytokin i cząsteczek efektorowych po krótkotrwałej (6 godzin) stymulacji pulami peptydów. Nasze laboratorium opracowało i zatwierdziło test i obecnie używamy tej metody do ilościowego określania odpowiedzi limfocytów T Th1/Th2 CD4+ i CD8+ w badaniach szczepionek SARS-CoV-2. Tutaj oceniliśmy odpowiedzi komórek T na białka strukturalne SARS-CoV-2 (S, E, M i N) i pomocnicze (ORF 3a, 6, 7a, 7b i 8) przy użyciu nakładających się puli peptydów, które obejmują sekwencje tych białka.
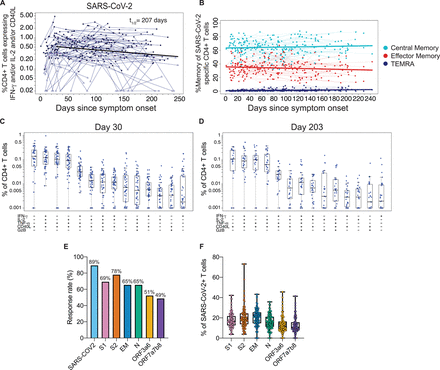
Wśród pacjentów z COVID-19, u 89% (102/113) wystąpiły odpowiedzi limfocytów T CD4+ ( Figura 5A ) rozpoznające co najmniej jedno białko strukturalne SARS-CoV-2, które było wykrywalne podczas jednej lub więcej wizyt. Przeciwnie, limfocyty T CD4+ specyficzne dla SARS-CoV-2 były rzadko wykrywane w niezakażonej grupie kontrolnej przy użyciu tego testu (Figura S3C). Swoiste dla antygenu limfocyty T CD4+ namnażały się w ciągu pierwszego miesiąca po zakażeniu, a następnie stopniowo zanikały w kolejnych miesiącach. Ich szacowany okres półtrwania wynosił 207 dni (95%CI [104, 211]), jak pokazano na rycinie 5A, a wyniki te są poparte indywidualnymi poziomami odpowiedzi limfocytów T CD4+ i nachyleniami po 30 dniu (nachylenie = -0,0033, 95% CI [-0,0017, -0,0066], p<0,0001) (ryc. S4C, D). Warto zauważyć, że zaobserwowaliśmy szeroki zakres całkowitej wielkości odpowiedzi, niektóre sięgające >1% krążących limfocytów T CD4+ i ogólną medianę częstotliwości 0,51% ( Figury 5A i S5 ).
Rysunek 5.Odpowiedzi komórek T CD4+ na antygeny SARS-CoV-2.
(A) Suma limfocytów T CD4+ z odjętym tłem eksprymującym ex vivo IFN-γ, IL-2 i/lub CD40L do puli peptydów obejmujących białka strukturalne SARS-CoV-2: S1, S2, otoczka (E), błona (M ), nukleokapsyd (N) i następujące ORF: 3a, 3b, 6, 7a, 7b i 8 (n=114) dla każdego osobnika/punktu czasowego. Każda próbka, która jest „dodatnia” (według MIMOSA) dla co najmniej jednego antygenu SARS-CoV-2 jest oznaczona pełnym kółkiem, podczas gdy próbki „ujemne” dla wszystkich antygenów SARS-CoV-2 w tym punkcie czasowym są wskazane przez otwarte trójkąty. Pogrubiona linia przedstawia medianę dopasowanej krzywej z nieliniowego modelu efektów mieszanych odpowiedzi po 30 dniach wśród osób z pozytywną odpowiedzią w >= 1 punkcie czasowym; t 1/2to mediana okresu półtrwania oszacowana na podstawie mediany nachylenia, z 95% CI [104, 411]. (B) Odsetek limfocytów T CD4+ specyficznych dla SARS-CoV-2 wyrażających określony fenotyp pamięci w czasie: pamięć centralna (CCR7+ CD45RA-), pamięć efektorowa (CCR7-CD45RA-) lub T EMRA(CCR7-CD45RA+); ograniczone do „pozytywnych” respondentów. Polifunkcjonalność limfocytów T CD4+ specyficznych dla SARS-CoV-2 wykazano w (C) 21-60 dniach od wystąpienia objawów (mediana, 30 dni) i (D) >180 dni mediana po wystąpieniu objawów (mediana, 203 dni). Odsetek limfocytów T CD4+ eksprymujących cytokiny jest odejmowany od tła i wyświetlane są tylko podzbiory z wykrywalnymi limfocytami T. Przedstawione dane były ograniczone do „pozytywnych” respondentów i jednego punktu danych na osobę w przedziale czasowym. Wszystkie podzbiory były również oceniane pod kątem ekspresji IL-4, IL-5, IL-13, IL-17 i perforyny i okazały się negatywne. (E) Wykresy słupkowe wskazują odsetek pacjentów powracających do zdrowia z powodu COVID-19, którzy mieli pozytywną odpowiedź komórek T CD4+ na poszczególne SARS-CoV-2. pula peptydów ex vivostymulacje. Niektóre antygeny połączono w celu stymulacji, jak wskazano. (F) Dla każdego osobnika z pozytywnymi limfocytami T CD4+ specyficznymi dla SARS-CoV-2, proporcja wszystkich limfocytów T CD4+ odpowiadających SARS-CoV-2, które są specyficzne dla każdej stymulacji.
Aby lepiej scharakteryzować rozwój pamięci komórek T w zakażeniu SARS-CoV-2, zbadaliśmy wzdłużnie profile różnicowania komórek T swoistych dla wirusa u pacjentów z COVID-19. W oparciu o ekspresję CD45RA i CCR7, limfocyty T CD4+ specyficzne dla SARS-CoV-2 były przede wszystkim fenotypem pamięci centralnej (CD45RA-CCR7+) iw mniejszym stopniu pamięci efektorowej (CCRA-CCR7-); ten profil podzbiorów komórek T pamięci był bardzo spójny między osobnikami i stabilny w czasie ( Figura 5B ). Swoiste antygenowo limfocyty T CD4+ wykazywały stronniczość Th1 z dominującym fenotypem CXCR3+CCR6 i były wysoce wielofunkcyjne, z jednoczesnym wykrywaniem swoistych antygenowo CD154, IFN-γ, IL-2, TNF-α i rzadziej granzymu B w wczesna faza ekspansji (21-60 dni po wystąpieniu objawów; mediana, 30 dni) ( Rysunek 5C). Co ciekawe, wiele limfocytów T CD4+ specyficznych względem wirusa również wykazywało tę wielofunkcyjność w punkcie czasowym pamięci (>180 dni po wystąpieniu objawów; mediana, 203 dni) ( Figura 5D ). Nie wykryto krążących podzbiorów Th2 specyficznych dla SARS-CoV-2 (IL-4, IL-5 i IL-13), Th17 (IL-17) ani podzbiorów z ekspresją perforyny ( Figura 5C i D ).
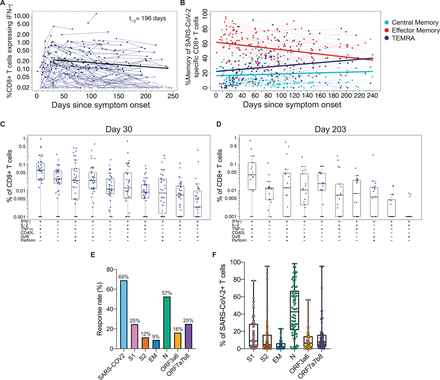
Następnie zbadaliśmy odpowiedzi limfocytów T CD8+ u pacjentów z COVID-19 i stwierdziliśmy, że 69% wygenerowało limfocyty T CD8+ rozpoznające co najmniej jedno białko strukturalne SARS-CoV-2, które były wykrywalne podczas jednej lub więcej wizyt ( Figura 6A ), w przeciwieństwie do rzadkie lub rzadkie, odpowiedzi specyficzne dla antygenu o niskim poziomie u niezakażonych dawców kontrolnych (ryc. S3D).
Rysunek 6.Odpowiedzi komórek T CD8+ na antygeny SARS-COV-2.
(A) Suma limfocytów T CD8+ po odjęciu tła wyrażających IFN-γ (z innymi cytokinami lub bez), w odpowiedzi na pule peptydów pokrywających białka strukturalne SARS-CoV-2: S1, S2, otoczka (E), błona (M ), nukleokapsyd (N) i następujące ORF: 3a, 3b, 6, 7a, 7b i 8 (n=114) dla każdego osobnika/punktu czasowego. Każda próbka, która jest „dodatnia” (MIMOSA) dla co najmniej 1 antygenu SARS-CoV-2 jest oznaczona pełnym kółkiem, podczas gdy próbki „ujemne” dla wszystkich antygenów SARS-CoV-2 w tym punkcie czasowym są oznaczone otwarte trójkąty. Pogrubiona czarna linia przedstawia medianę dopasowanej krzywej z nieliniowego modelu efektów mieszanych odpowiedzi po 30 dniach wśród osób z pozytywną odpowiedzią na rozważany(e) antygen(y) w ≥ 1 punkcie czasowym; t 1/2pokazano medianę okresu półtrwania oszacowaną na podstawie nachylenia mediany, z 95% CI [92, 417]. (B) Proporcja limfocytów T CD8+ specyficznych wobec SARS-CoV-2 według fenotypu pamięci w czasie: pamięć efektorowa (EM; CCR7-CD45RA-), T EMRA(CCR7-CD45RA+) i pamięci centralnej (CM; CCR7+ CD45RA-). Analizy ograniczono do respondentów „pozytywnych”. Wielofunkcyjność limfocytów T CD8 specyficznych dla SARS-CoV-2 w (C) 21-60 dni od wystąpienia objawów (mediana, 30 dni) i (D) >180 dni od mediany od wystąpienia objawów (mediana, 203 dni). Odsetek limfocytów T CD8+ eksprymujących cytokiny jest odejmowany od tła i wyświetlane są tylko podzbiory z wykrywalnymi limfocytami T. Przedstawione dane były ograniczone do osób z pozytywnymi odpowiedziami i jednego punktu danych na osobę w przedziale czasowym. Wszystkie podzbiory komórek T CD8+ oceniano również pod kątem ekspresji IL-4, IL-5, IL-13 i IL-17 i stwierdzono, że są ujemne. (E) Wykresy słupkowe wskazują odsetek pacjentów powracających do zdrowia z powodu COVID-19, którzy mieli „dodatnią” odpowiedź komórek T CD8+ na poszczególne stymulacje SARS-CoV-2.
Ekspansja limfocytów T CD8+ wystąpiła w ciągu pierwszego miesiąca, a następnie częstość stopniowo malała, z okresem półtrwania wynoszącym 196 dni (95% CI [92, 417]) i ujemnym oszacowanym nachyleniem po 30 dniach od wystąpienia objawów (nachylenie =-0,004 , 95% CI [-0,002, -0,008], p<0,0001 ( Figura 6A ). Mediana częstości limfocytów T CD8+ specyficznych dla SARS-CoV-2 wynosiła 0,2%, co wskazuje na niższą ogólną wielkość odpowiedzi niż obserwowana dla limfocytów T CD4+.
Jednakże, podobnie jak limfocyty T CD4+, zaobserwowano szeroki zakres wielkości przy częstości występowania wielu limfocytów T CD8+ specyficznych dla SARS-CoV-2 powyżej 1%, a nawet do 12% ( Figura 6A ). Bardzo różny wzór zmian fenotypowych zaobserwowano w przypadku komórek T CD8+ specyficznych wobec wirusa w porównaniu z tym, co widzieliśmy w przypadku komórek T CD4+ ( Figura 6B vs. Figura 5B ). W przeciwieństwie do dominacji centralnego podzbioru pamięci z limfocytami T CD4+ specyficznymi dla SARS-CoV-2, zdecydowana większość limfocytów T CD8+ swoistych dla wirusa wykazywała fenotyp pamięci efektorowej we wczesnej fazie odpowiedzi. Jednak ta populacja pamięci efektorowej specyficznej dla SARS-CoV-2 (CD45RA-CCR7-) kurczyła się w czasie (nachylenie = -0,904, p<0,0001; Rysunek 6B) i jednocześnie nastąpił wzrost proporcji podzbioru TEMRA (CD45RA+CCR7-) limfocytów T CD8+ specyficznych względem wirusa (nachylenie=0,075, p<0,0001; Figura 6B ). Niewielka, ale stabilna frakcja limfocytów T CD8+ specyficznych dla SARS-CoV-2 wyrażała centralny fenotyp pamięci (nachylenie=0,024, p=ns; Figura 6B ).
Komórki T CD8+ specyficzne dla SARS-CoV-2 były wysoce wielofunkcyjne z populacjami o największej sile wydzielania IFN-γ, TNF-α i granzym B; inne dominujące podzbiory również eksprymowały IL-2 lub perforynę ( Figura 6C , D). Ten wielofunkcyjny profil zaobserwowano w fazie ekspansji (mediana 30 dni; Figura 6C ), a także w późniejszych punktach czasowych (>180 dni po wystąpieniu objawów; mediana 203 dni; Figura 6D ). Należy zauważyć, że ten wzór różnicowania komórek T CD8+ został szczegółowo opisany po szczepieniu ludzi żywą atenuowaną szczepionką przeciwko wirusowi żółtej gorączki (YFV-17D) ( Akondy i wsp., 2017 ). Ta szczepionka YFV-17D generuje długowieczne i funkcjonalne limfocyty T CD8+ pamięci specyficzne dla wirusa, które utrzymują się u ludzi przez dziesięciolecia (Akondy i in., 2017 ; Veit i in., 2018 ). To, że program różnicowania limfocytów T CD8+ po zakażeniu COVID-19 przypomina to, co obserwuje się u ludzi po zakażeniu YFV, sugeruje, że pacjenci z COVID-19 mogą również generować długo żyjącą pamięć limfocytów T CD8+.
Komórki CD4+ i CD8+ celują w różne swoistości antygenowe SARS-CoV-2
Większość pacjentów z COVID-19 wytworzyła limfocyty T CD4+, które rozpoznawały większość wirusowych białek strukturalnych i pomocniczych SARS-CoV-2, z najwyższym odsetkiem odpowiedzi na S2 (78%) i S1 (69%) ( Figura 5E , F). Wśród osobników COVID-19 z odpowiedziami pozytywnymi proporcja limfocytów T CD4+ specyficznych dla SARS-CoV-2 reagujących na każdą pulę peptydów była równomiernie rozłożona ( Figura 5F ). Tak więc limfocyty T CD4+ w równym stopniu celowały w wiele białek SARS-CoV-2.
W przeciwieństwie do wyników obserwowanych dla limfocytów T CD4+, limfocyty T CD8+ specyficzne dla SARS-CoV-2 wykazywały preferencyjne rozpoznawanie białka nukleokapsydu. Dominujący odsetek odpowiedzi limfocytów T CD8+ był skierowany na nukleokapsyd (57%), następnie ORF 7a, 7b i/lub 8 (25%), S1 (25%), ORF 3a i/lub 6 (16%), S2 (12%) i E i/lub M (9%) ( Figura 6E ). Ponadto wśród pacjentów z COVID-19 z odpowiedziami limfocytów T CD8+ wystąpił błąd z największym odsetkiem (mediana, 43%) reagującym na białko nukleoprokapsydowe ( Rysunek 6F). Podczas gdy wskaźniki odpowiedzi limfocytów T SARS-CoV-2 CD8+ były znacznie niższe u niezakażonych kontroli, gdy były obecne u kilku dawców kontrolnych z mniejszą częstością, były one również ukierunkowane na białko nukleokapsydu (Figura S3D). Prawdopodobnym wyjaśnieniem tych ustaleń jest to, że w zakażeniu SARS-CoV-2 komórki prezentujące antygen in vivo mogą wykazywać wyższy udział peptydów pochodzących z białka nukleokapsydu, a zatem podczas infekcji powstaje więcej komórek T CD8+ specyficznych dla nukleokapsydu. Ma to interesujące implikacje sugerujące, że limfocyty T CD8+ specyficzne dla nukleokapsydu mogą być bardziej skuteczne w rozpoznawaniu komórek zakażonych wirusem.
Wiek i ciężkość choroby są istotnie związane z nasileniem odpowiedzi immunologicznych SARS-CoV-2
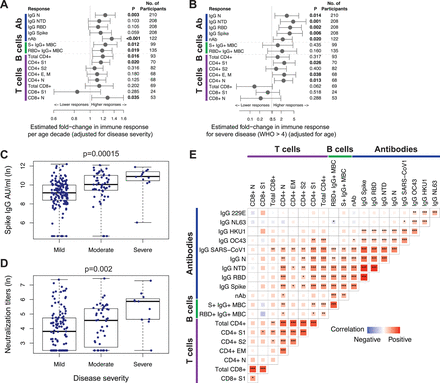
Oceniliśmy, czy wiek, nasilenie choroby lub płeć pacjenta z COVID-19 mogą częściowo odpowiadać za niejednorodność obserwowaną wśród odpowiedzi immunologicznych specyficznych dla SARS-CoV-2, jak oszacowano na podstawie poszczególnych modeli (po 30. dniu dla komórek i po 42. dniu dla odpowiedzi przeciwciał). Zaobserwowaliśmy, że wiek był istotnie związany z wyższą odpowiedzią immunologiczną na SARS-CoV-2, niezależnie od jakiejkolwiek kowariancji z ciężkością choroby ( Rysunek 7A). Miana przeciwciał neutralizujących i odpowiedzi przeciwciał IgG na nukleokapsyd wzrosły odpowiednio 1,35-krotnie i 1,25-krotnie w każdej dekadzie życia i przy takim samym nasileniu choroby (95%CI [1,19, 1,54] i [1,08, 1,43], wartości p<0,003 ). Podobnie, wyższy wiek dodatnio korelował ze zwiększoną częstością komórek B pamięci IgG+ swoistych dla kolców i RBD, z 1,19 do 1,24-krotnie wyższymi odpowiedziami na dekadę życia (wartości p<0,02; Figura 7A ), co odpowiada za ciężkość choroby. Wyższy wiek korelował również z wyższymi odpowiedziami limfocytów T CD4+ wobec SARS-CoV-2 i S1 (1,16-1,20-krotny wzrost w ciągu dekady życia, wartości p<0,02) i odpowiedziami limfocytów T CD8+ swoistych dla N (1,24-krotny wzrost o dekada wieku, p=0,039) biorąc pod uwagę ciężkość choroby ( Figura 7A ).
Rysunek 7.Korelacje między odpowiedziami immunologicznymi specyficznymi dla SARS-CoV-2 a oceną współzmiennych.
(A) Wykres leśny przedstawia szacowaną krotność zmiany poziomu każdej odpowiedzi immunologicznej na dekadę życia, z 95% CI i wartościami p według Walda. (B) Wykres leśny przedstawia szacowaną krotność zmiany poziomu każdej odpowiedzi immunologicznej dla choroby ciężkiej (wynik WHO > 4) w porównaniu z nieciężką (wynik WHO ≤ 4), z 95% CI opartymi na Waldu i p- wartości. Odpowiedzi limfocytów T S1 CD8+ porównały umiarkowanie ciężką (wynik WHO > 2) do łagodnej (wynik WHO ≤ 2) chorobę, ponieważ nie było uczestników z ciężką chorobą z co najmniej jedną pozytywną odpowiedzią limfocytów T S1 CD8+ po 30. dniu. A) i (B) pochodzą z modeli efektów mieszanych po 30 dniu (odpowiedzi limfocytów B i T) lub po 42 dniu (odpowiedzi przeciwciał) wśród respondentów, które uwzględniają stały wpływ wieku i nasilenia choroby na poziom odpowiedzi immunologicznej . Jednoczynnikową ocenę ciężkości choroby na podstawie wielkości (C) przeciwciał IgG typu kolca i (D) przeciwciał neutralizujących SARS-CoV-2 w dniu 120 przedstawiono dla łagodnych (wynik WHO: 0-2), umiarkowanych (wynik WHO: 3-4). ) i ciężką chorobę (wynik WHO: 5+); wartości p z jednoczynnikowej analizy ANOVA. (E) Mapa cieplna pokazuje korelacje Spearmana między krytycznymi odpowiedziami odpornościowymi na pamięć SARS-CoV-2 (odpowiedź komórek B i T w dniu 30 oraz odpowiedź przeciwciał w dniu 180) z poziomami istotności: *p<0,05, **p<0,01, *** p<0,001. Rozmiar kafelka i intensywność koloru odpowiadają wartości bezwzględnej współczynnika korelacji rang Spearmana, przy czym kolor czerwony lub niebieski oznacza odpowiednio dodatnią lub ujemną korelację. Odpowiedzi immunologiczne w dniach 30, 42 i 180 oszacowano na podstawie modeli efektów mieszanych podłużnych przeciwciał wiążących SARS-CoV-2, przeciwciał neutralizujących SARS-CoV-2,
Ponieważ kohorta obejmowała głównie osoby z łagodnym do umiarkowanego COVID-19, mieliśmy ograniczone możliwości oceny związku ciężkiej choroby i odpowiedzi immunologicznych SARS-CoV-2, szczególnie wśród odpowiedzi komórkowych. Stwierdziliśmy jednak, że po uwzględnieniu wieku ciężka choroba (wynik WHO >4) była związana z wyższymi przeciwciałami IgG przeciwko nukleokapsydowi, kolce, RBD i NTD ( ryc. 7B , C) i mianom neutralizacji SARS-CoV-2 ( ryc. 7D ). Ciężka choroba była również powiązana z 2,30 do 2,46-krotnie wyższymi S1, E i/lub M oraz limfocytami T CD4+ specyficznymi dla nukleokapsydu (wszystkie wartości p<0,05; Ryc. 7B). Po uwzględnieniu wieku i ciężkości choroby, po uwzględnieniu wieku i ciężkości choroby, nie znaleźliśmy żadnych istotnych związków między płcią a ocenianymi odpowiedziami odpornościowymi, poza 1,66-krotnie wyższymi przeciwciałami IgG NTD u mężczyzn w porównaniu z kobietami (95% CI [1,08, 2,55], p=0,022). . Podsumowując, nasze analizy sugerują, że istnieją synergistyczne, ale także niezależne mechanizmy napędzające silniejszą adaptacyjną odpowiedź immunologiczną u pacjentów z COVID-19, którzy są starsi i / lub którzy doświadczyli cięższej choroby.
Wczesne odpowiedzi limfocytów B i T SARS-CoV-2 skorelowane z trwałym skokiem i mianem przeciwciał RBD IgG wiązania i neutralizacji
Oceniliśmy korelacje między odpowiedziami immunologicznymi specyficznymi dla SARS-CoV-2 przy użyciu modeli na poziomie indywidualnym, aby interpolować wielkość odpowiedzi dla każdego pacjenta z COVID-19 we wczesnych (dzień 30) lub później (dzień 180) punktach czasowych rekonwalescencji ( Rysunek 7E). Stwierdziliśmy, że trwałe miana neutralizacji surowicy korelowały z wielkością przeciwciał wiążących IgG+ przeciwko kolce, NTD i RBD w 180 dniu każdego dnia (dzień 180; Spearman R=0,62, 0,61 i 0,61, wszystkie wartości p<0,0001). Podobnie częstość komórek B pamięci RBD+ IgG+ w 30 dniu korelowała z utrzymaniem przeciwciał RBD+ IgG (dzień 180; Spearman R=0,53, p<0,0001) i mianem przeciwciał neutralizujących (dzień 180; Spearman R=0,48, p<0,0001). ). Zaobserwowaliśmy również, że wielkość limfocytów T CD4+ specyficznych dla S1 w dniu 30 korelowała z trwałymi przeciwciałami IgG przeciwko kolce (dzień 180; Spearman R=0,56, p<0,0001), NTD (Spearman R=0,62, p<0,0001) i RBD (Spearman R=0,47, p=0,0002) ( Rysunek 7E). Odkrycia te są zgodne z wczesnymi limfocytami B pamięci SARS-CoV-2 i limfocytami T CD4+ wspierającymi generowanie trwałych odpowiedzi przeciwciał.
DYSKUSJA
Ustanowienie pamięci immunologicznej jest niezbędne w obronie przed zakażeniem SARS-CoV-2. Aby zakończyć pandemię COVID-19, bardzo ważne jest, aby wiedzieć, jak długo odporność na SARS-CoV-2 utrzyma się po zakażeniu i czy będzie wystarczająca, aby zapobiec nowym infekcjom i ciężkim chorobom w nadchodzących latach. Dogłębna identyfikacja adaptacyjnych elementów immunologicznych prowadzących do wyzdrowienia i modelowanie trendów każdej odpowiedzi umożliwiła próbkowanie podłużne dużej liczby pacjentów z COVID-19. Tutaj pokazujemy, że większość rekonwalescencyjnych pacjentów z COVID-19 montuje trwałe przeciwciała, limfocyty B i T specyficzne dla SARS-CoV-2 do 250 dni, a kinetyka tych odpowiedzi zapewnia wczesne wskazanie korzystnego kursu do osiągnięcia długo- przeżył odporność. Ponieważ kohorta będzie śledzona jeszcze przez 2-3 lata,
Cechą charakterystyczną początkowej obrony immunologicznej przed SARS-CoV-2 jest pojawienie się we wczesnej fazie replikacji wirusa przeciwciał rozpoznających białko wypustek SARS-CoV-2, w tym składniki RBD i NTD podjednostki S1. Przeciwciała te są prawdopodobnie wydzielane z plazmablastów szybko generowanych przez komórki B, które są aktywowane po pierwszym kontakcie z antygenem wypustki patogenu. Szybki wzrost w ciągu pierwszego miesiąca infekcji, po którym następuje szybki spadek liczby krążących kolczastych przeciwciał IgG i IgA, jest konsekwentnym odkryciem i prawdopodobnie można go wytłumaczyć zanikiem krótko żyjących plazmablastów. Zdarzenia te występują jeszcze wcześniej w przypadku wypustek IgM i przeciwciał nukleokapsydowych.
Niektóre przeciwciała, które wiążą się ze specyficznymi epitopami na kolce RBD i NTD mogą blokować infekcję SARS-CoV-2 komórek nabłonka oddechowego poprzez hamowanie interakcji kolca wirusa z receptorem ACE2 ( Ju et al., 2020 ; Seydoux et al., 2020 ; Walls i wsp., 2020 ; Zost i wsp., 2020 ). Tak więc, zgodnie z oczekiwaniami, wczesny wzrost i spadek przeciwciał neutralizujących żywy SARS-CoV-2 był podobny do kinetyki przeciwciał wiążących wypustkę i białko RBD. Uderzającym odkryciem jest dwufazowa krzywa odpowiedzi przeciwciał swoistego wiązania i neutralizacji podczas analizy za pomocą modelu potęgowego, która zapewnia lepsze dopasowanie kinetyki przeciwciał po odpowiedzi szczytowej ( Zarnitsyna i wsp., 2021). Dzięki przedłużeniu danych z pobierania próbek do 250 dni byliśmy w stanie wykryć spowolnienie rozpadu tych funkcjonalnych przeciwciał w kierunku poziomu plateau, co sugeruje wytwarzanie dłużej żyjących komórek plazmatycznych i trwałe odpowiedzi przeciwciał. Znaczenie tych obserwacji polega na tym, że po wyzdrowieniu przeciwciała neutralizujące mogą utrzymywać się, aczkolwiek na niskim poziomie, i mogą działać jako pierwsza linia obrony przed przyszłymi spotkaniami z SARS-CoV-2 i prawdopodobnie pokrewnymi ludzkimi koronawirusami.
Innym interesującym odkryciem tego badania jest niezwykle stabilna odpowiedź przeciwciał wśród pacjentów przed pandemią i COVID-19 na powszechne ludzkie koronawirusy, które są nabywane u dzieci i dorosłych. Dane te są najbardziej zgodne z generowaniem długo żyjących komórek plazmatycznych i obalają obecny pogląd, że te odpowiedzi przeciwciał na ludzkie koronawirusy są krótkotrwałe. Co więcej, pacjenci z COVID-19 uzyskali zwiększoną odpowiedź przeciwciał IgG na SARS-CoV-1, pokrewny patogen, którego prawdopodobnie nikt nie doświadczył wcześniej. To odkrycie jest zgodne z odpowiedzią przypominającą przeciwciał neutralizujących SARS-CoV-1, którą ostatnio zaobserwowaliśmy po szczepieniu SARS-CoV-2 mRNA ( Doria-Rose i wsp., 2021 ; Stamatatos i wsp., 2021). Podsumowując, wyniki te mogą mieć implikacje dla szerszej strategii szczepionek skierowanych przeciwko wielu betakoronawirusom.
Trwałe odpowiedzi przeciwciał w okresie rekonwalescencji COVID-19 są dalej potwierdzane przez trwający wzrost odpowiedzi komórek B pamięci typu „skok” i RBD po ponad 3-5 miesiącach przed wejściem w fazę plateau w ciągu 6-8 miesięcy. Odnotowano utrzymywanie się komórek B pamięci RBD ( Dan et al., 2021 ; Gaebler et al., 2021 ; Rodda et al., 2021). Przypuszczamy, że można to wytłumaczyć ciągłym wytwarzaniem komórek B pamięci w ośrodkach rozmnażania węzłów chłonnych drenujących drogi oddechowe we wczesnych miesiącach, a następnie redystrybucją komórek B pamięci do krążenia, gdy ośrodki rozmnażania zaczynają się cofać. Zatem indukcja i utrzymywanie komórek B pamięci i, z biegiem czasu, długo żyjących komórek plazmatycznych, będzie nadal dostarczać przeciwciała o wyższym powinowactwie, jeśli nastąpi ponowne narażenie.
W przeciwieństwie do skokowej kinetyki komórek B pamięci, limfocyty T pamięci CD4+ i CD8+ specyficzne dla SARS-CoV-2 osiągają szczyt wcześnie, w ciągu pierwszego miesiąca, ale następnie powoli spadają w ciągu następnych 6-7 miesięcy. Limfocyty T CD4+ typu Th1 pamięci centralnej dominują we wczesnym okresie infekcji i rekonwalescencji. Jednak komórki T CD8+ wykazują dominujący fenotyp efektorowy pamięci wcześnie, który przechodzi do tych efektorowych komórek pamięci z reekspresją CD45RA, utrzymując ekspresję cytokin przeciwwirusowych i funkcje efektorowe, które, jak wykazano, zapewniają ochronną odporność przeciwko innym patogenom wirusowym.
Dostarczamy również wyraźnych dowodów na to, że limfocyty T CD4+ wytwarzają szerszą odpowiedź swoistą dla antygenu w obrębie produktów genów strukturalnych i pomocniczych, podczas gdy limfocyty T CD8+ są głównie swoiste dla nukleokapsydu, a odpowiedzi swoiste na igłę są znacznie rzadsze.
Nasze badanie wykazuje znaczną niejednorodność immunologiczną w generowaniu potencjalnie ochronnej odpowiedzi przeciwko SARS-CoV-2, a skupiając się na dynamice i utrzymaniu odpowiedzi pamięciowych komórek B i T, byliśmy w stanie zidentyfikować cechy tych wczesnych odpowiedzi komórkowych, które mogą prognozować trwałość potencjalnie skutecznej odpowiedzi przeciwciał. Zdolność do montowania wyższych częstotliwości komórek B pamięci IgG+ swoistych dla RBD na wczesnym etapie infekcji była najlepszym wskaźnikiem trwałego przeciwciała IgG swoistego dla RBD i odpowiedzi przeciwciał neutralizujących. Ponadto, limfocyty T CD4+ o wyższej częstotliwości były związane z silniejszymi reakcjami na wypustki IgG i przeciwciałami neutralizującymi.
Jednak indukcja i szczytowa odpowiedź limfocytów T CD8+ specyficznych dla SARS-CoV-2 zachodzi niezależnie od tych odpowiedzi przeciwciał. Co ciekawe, chociaż powszechnie donoszono, że wiek koreluje z nasileniem choroby COVID-19, odkryliśmy, że wiek i ciężkość choroby były niezależnymi współzmiennymi związanymi z wielkością zarówno limfocytów T CD4+ specyficznych dla SARS-CoV-2, jak i humoralnej SARS- Odporność na CoV-2, ale nie na poziomie odpowiedzi limfocytów T CD8+. W przypadku limfocytów T, czy różnice limfocytów T są związane z częstością lub specyficznością istniejącej wcześniej odporności limfocytów T CD4+ i CD8+ na koronawirusa, będzie wymagało dodatkowej analizy w przyszłości.
Pandemia COVID-19 pozostaje globalnym zagrożeniem dla zdrowia publicznego po roku przytłaczających zakłóceń i strat. Pokonanie wyzwań związanych z zakończeniem pandemii jest podkreślone przez uznanie, że SARS-CoV-2 może podlegać szybkiej zmienności antygenowej, która może obniżyć skuteczność szczepionki w zapobieganiu nowym przypadkom i progresji do ciężkiej choroby ( Edara i wsp., 2021 ; Mascola i wsp., 2021 ; Stamatatos i in., 2021). Nasze odkrycia pokazują, że większość pacjentów z COVID-19 indukuje szeroko zakrojoną obronę immunologiczną przeciwko infekcji SARS-CoV-2, obejmującą przeciwciała i limfocyty B pamięci rozpoznające zarówno RBD, jak i inne regiony kolca, szeroko specyficzne i wielofunkcyjne limfocyty T CD4+, i wielofunkcyjne limfocyty T CD8+. Odpowiedź immunologiczna na naturalną infekcję z dużym prawdopodobieństwem zapewni ochronną odporność nawet przeciwko wariantom SARS-CoV-2, ponieważ epitopy komórek T CD4+ i CD8+ zostaną zachowane. Tak więc odzyskani pacjenci z COVID-19 prawdopodobnie lepiej bronią się przed wariantami niż osoby, które nie zostały zakażone, ale zostały zaszczepione tylko szczepionkami zawierającymi kolce. Niemniej jednak, indukcja szczepionkowa komórek T CD8+ do bardziej konserwatywnych antygenów, takich jak nukleokapsyd, a nie tylko do antygenów wypustek SARS-CoV-2,
Covid-19 – układ odpornościowy zapewnia trwałą obronę po wyzdrowieniu
HCQ – Chlorochina – Hydroksychlorochina jest skuteczny w przypadku COVID-19 meta analiza 187 badań
15 milionów Polaków jest już organizmami GMO – istotami trwale zmodyfikowanymi genetycznie
Originally posted 2021-06-09 02:47:16.