To co jeszcze kilka miesięcy temu było tylko teorią , dziś jest naukowo potwierdzoną prawdą.
Oto podsumowanie w jednym zdaniu poniżej wklejonej pracy badawczej – cytuje:
„Podsumowując, szczepionka mRNA BNT162b2 wywołuje złożone, funkcjonalne przeprogramowanie wrodzonej odpowiedzi immunologicznej”
Praca odnosi się tylko do szczepionki Pfizera, jednak Moderna to identyczne działanie, a w innej pracy z spisu źródeł można znaleźć informację, że i Astra i Jonson mają taki sam mechanizm trwałego przeprogramowania ludzkiego DNA
Inny cytat:
„Wyniki te łącznie pokazują, że działanie szczepionki BNT162b2 wykracza poza adaptacyjny układ odpornościowy i może również modulować wrodzoną odpowiedź immunologiczną.” – od redaktora tekstu – czyli inaczej prostym językiem – trwale zmienić DNA by reagowało w nowy zaprogramowany sposób !
Co ciekawe praca potwierdza , że większość tak zwanych tradycyjnych szczepionek w tym powszechna BCG czy MMR , także trwale modyfikują DNA i ciała dzieci cytuje:
„Oprócz wpływu na specyficzną (adaptacyjną) pamięć immunologiczną, niektóre szczepionki, takie jak Bacillus Calmette-Guérin (BCG) oraz szczepionka przeciwko odrze, śwince i różyczce (MMR), również indukują długoterminowe funkcjonalne przeprogramowanie komórek wrodzonego układu odpornościowego. „
Ciekawe pytanie się nasuwa – czy na ziemi żyją jeszcze gdzie ludzie, którzy mają czyste nie zmodyfikowane DNA ?
A tu inny cytat z poniższego badani:
„Dane te potwierdzają dowody na to, że B.1.351 i prawdopodobnie inne warianty mogą w pewnym stopniu być w stanie uniknąć odporności humoralnej wywołanej szczepionką ( Kustin i in., 2021 ).” i z innego miejsca: „Podsumowując, nasze dane pokazują, że szczepionka BNT162b2 wywołuje wpływ zarówno na adaptacyjną, jak i wrodzoną gałąź odporności i że te efekty są różne dla różnych szczepów SARS-CoV-2. „
Czyli po Polsku łopatologicznie – szczepionka jest nieskuteczna na nowe warianty wirusa – co udowodniono praktycznie i empirycznie już w INDIACH – a ta zmutowana wersja wirus została już zaimportowana do Polski i staje się dominująca w Anglii – czyli jest tylko kwestią czasu jak wraz z rodakami z UK masowo znajdzie się w Polsce.
A tu jeszcze ciekawiej się robi:
Szczepionki COVID-19 mogą nie zapobiegać zakażeniom nosa SARS-CoV-2 i bezobjawowej transmisji
Cytat: : Sugeruje to, że pacjenci szczepieni ogólnoustrojowo (w ramię) , mimo że nie mają objawów, mogą nadal zostać zakażeni
i przenosić żywego wirusa z górnych dróg oddechowych.
Oparta na mRNA szczepionka BNT162b2 firmy Pfizer / BioNTech była pierwszą zarejestrowaną szczepionką COVID-19 i wykazano, że jest do 95% skuteczna w zapobieganiu infekcjom SARS-CoV-2. Niewiele wiadomo na temat szerokich skutków nowej klasy szczepionek mRNA, zwłaszcza czy mają one łączny wpływ na wrodzoną i adaptacyjną odpowiedź immunologiczną. Tutaj potwierdziliśmy, że szczepienie BNT162b2 zdrowych osób wywołało skuteczną odporność humoralną i komórkową przeciwko kilku wariantom SARS-CoV-2. Co ciekawe, szczepionka BNT162b2 również modulowała wytwarzanie cytokin zapalnych przez wrodzone komórki odpornościowe po stymulacji zarówno specyficznymi (SARS-CoV-2), jak i niespecyficznymi (wirusowymi, grzybowymi i bakteryjnymi) bodźcami. Odpowiedź komórek odporności wrodzonej na ligandy TLR4 i TLR7 / 8 była niższa po szczepieniu BNT162b2, podczas gdy odpowiedzi cytokinowe indukowane przez grzyby były silniejsze. Podsumowując, szczepionka mRNA BNT162b2 wywołuje złożone, funkcjonalne przeprogramowanie wrodzonej odpowiedzi immunologicznej, co należy wziąć pod uwagę przy opracowywaniu i stosowaniu tej nowej klasy szczepionek.
Tekst główny
Choroba koronawirusa 2019 (COVID-19) to nowa infekcja dróg oddechowych wywołana przez koronawirusa 2 (SARS-CoV-2) ciężkiego ostrego zespołu oddechowego, który rozprzestrzenił się na całym świecie od końca 2019 r., Powodując globalną pandemię. Pandemia COVID-19 jest najważniejszym kryzysem zdrowotnym, z jakim ludzkość spotkała się od czasów II wojny światowej, w połączeniu z niszczycielskimi skutkami społecznymi i gospodarczymi. W obliczu tej krytycznej sytuacji w wielu krajach na całym świecie podjęto poważne wysiłki w celu opracowania szczepionek przeciwko COVID-19.
Do tej pory 13 szczepionek zostało zatwierdzonych do stosowania u ludzi („narzędzie do śledzenia szczepionek COVID-19 | RAPS”, nd). Skala pandemii doprowadziła do przyspieszenia rozwoju szczepionek opartych na nowych technologiach, takich jak szczepionki na bazie mRNA i wektorów wirusowych ( van Riel i de Wit, 2020 ). Jedna z najczęściej stosowanych szczepionek przeciw COVID-19 na świecie została opracowana we współpracy między BioNTech i Pfizer (BNT162b2). Ta szczepionka jest oparta na formułowanym w postaci nanocząsteczek lipidów, zmodyfikowanym nukleozydem mRNA, który koduje stabilizowaną przed fuzją formę spike (S) -białka pochodzącego ze szczepu SARS-CoV-2 wyizolowanego wcześnie w Wuhan w Chinach ( Walsh et al. , 2020 ). Kilka badań fazy 3 wykazało, że BNT162b2 wywołuje szerokie odpowiedzi humoralne i komórkowe, zapewniając ochronę przed COVID-19 (Sahin i in., 2020 ; Walsh i in., 2020 ).
Podczas gdy trwają globalne kampanie szczepień przeciwko zakażeniu SARS-CoV-2, główne wyzwania pozostają, zwłaszcza rozprzestrzenianie się nowych wariantów wirusa ( Madhi i in., 2021 ). Jedną z najbardziej widocznych mutacji podczas pandemii było zastąpienie kolca D614G pierwotnym szczepem Wuhan Hu-1 ( Korber i wsp., 2020 ). Wraz ze stale wzrastającą częstością zakażeń pojawiły się warianty SARS-CoV-2 z wieloma mutacjami kolców i po raz pierwszy wykryto je w Wielkiej Brytanii (linia B.1.1.7), RPA (linia B.1.351) i Brazylii (P. 1 rodowód). Warianty te budzą poważne obawy ze względu na ich potencjalny wpływ na nasilenie choroby, zdolność przenoszenia wirusa, wskaźniki ponownych zakażeń i skuteczność szczepionek ( Abdool Karim i de Oliveira, 2021 ).
https://www.mdpi.com/1999-4915/13/5/878/htm
Zdolność BNT162b2 do wywoływania skutecznej odporności humoralnej i komórkowej na nowe warianty SARS-CoV-2 dopiero teraz zaczyna być rozumiana. Podczas gdy neutralizacja B.1.1.7 była podobna lub tylko nieznacznie zmniejszona w porównaniu ze szczepem standardowym ( Muik i in., 2021 ; Wang, Nair i in., 2021 ), miana neutralizujące B.1.351 były znacznie obniżone ( Liu i wsp., 2021 ; Planas i wsp., 2021 ; Wang, Nair i wsp., 2021 ) po szczepieniu zdrowych ochotników BNT162b2. Z kolei odporność komórkowa na warianty wirusa wydaje się być mniej dotknięta ( Lilleri i in., 2021 ; Skelly i in., 2021). Ponadto niezbadanym obszarem jest to, czy szczepienie BNT162b2 prowadzi również do długoterminowego wpływu na wrodzoną odpowiedź immunologiczną: może to być bardzo istotne w przypadku COVID-19, w którym rozregulowany stan zapalny odgrywa ważną rolę w patogenezie i ciężkości choroby ( Tahaghoghi-Hajghorbani i in., 2020 ). Długoterminowa modulacja wrodzonej odpowiedzi immunologicznej była obszarem zwiększonego zainteresowania w ostatnich latach: liczne badania wykazały, że długoterminowe wrodzone odpowiedzi immunologiczne mogą być zwiększone ( wyszkolona odporność ) lub zmniejszone ( wrodzona tolerancja immunologiczna ) po niektóre szczepionki lub infekcje ( Netea i in., 2020 ).
W tym badaniu oceniliśmy wpływ szczepionki BNT162b2 mRNA COVID-19 zarówno na wrodzoną, jak i adaptacyjną (humoralną i komórkową) odpowiedź immunologiczną. Najpierw zbadaliśmy stężenie izotypów przeciwciał wiążących RBD i S przed szczepieniem (wartość podstawowa; t1), 3 tygodnie po pierwszej dawce 30 μg BNT162b2 (t2) i dwa tygodnie po drugiej dawce (t3) (ryc. S1A). Obliczyliśmy krotność zmian, porównując stężenia zarówno od t2, jak i t3 do wartości wyjściowych. Szczepienie BNT162b2 wywołało wysokie stężenia przeciwciał anty-S i anty-RBD już po pierwszym szczepieniu, a nawet silniejszą odpowiedź po drugiej dawce szczepionki. Zgodnie z oczekiwaniami, odpowiedzi IgG były najbardziej wyraźne, ze specyficznymi dla RBD medianami zmian w t2 i t3 wynoszącymi 56-krotnie i 1839-krotnie oraz zmianami S-specyficznymi 208-krotnie i 1100-krotnie, odpowiednio. Najniższy obserwowany-krotny wzrost poziomów przed szczepieniem skierowanych przeciwko IgG RBD był odpowiednio 14-krotny w t2 i 21-krotny w t3. W przypadku IgG swoistej dla S, krotność zmian była co najmniej 32-krotna w t2 i 339-krotna w t3. Jeśli chodzi o stężenia IgA, pojedyncza dawka szczepionki wywołała 7-krotny wzrost stężenia swoistego dla RBD i 35-krotny wzrost stężenia swoistego dla S. Druga dawka zwiększyła stężenia przeciwciał wywołane przez pierwsze szczepienie 24-krotnie i 52-krotnie, odpowiednio dla RBD i S. W porównaniu z IgG i IgA wzrost stężenia IgM był znacznie niższy. Stężenie specyficzne dla RBD tylko podwoiło się po pierwszej dawce i nie wzrosło dalej po drugiej dawce szczepionki. W przeciwieństwie do tego, zmiany specyficzne dla S były 11-krotnie w t2 i 20-krotnie w t3 (Fig. S1A).Sahin i in., 2020 ).
W celu zbadania zdolności neutralizującej surowicy przeciwko wariantom SARS-CoV-2, przeprowadziliśmy test neutralizacji redukcji łysinek o 50% (PRNT50) przy użyciu surowic zebranych dwa tygodnie po drugiej szczepionce. Wszystkie próbki surowicy zneutralizowały szczep D614G i wariant B.1.1.7 z mianami co najmniej 1:80. Jednak sześciu badanych (37,5%) miało miana niższe niż 1:80 w porównaniu z wariantem B.1.351. Geometryczne średnie miana neutralizujące wobec szczepu D614G, B.1.1.7 i B.1.351 wynosiły odpowiednio 381, 397 i 70 (Figura S1B, p <0,001). Podobnie jak w naszym badaniu, kilka badań wykazało 6 do 14-krotnie zmniejszoną aktywność neutralizującą surowic po szczepieniu przeciwko wariantowi B.1.351 i tylko nieznacznie zmniejszoną aktywność przeciwko B.1.1.7, w porównaniu ze szczepem standardowym ( Planas et al. ., 2021 ;Shen i in., 2021 ; Wang, Liu i in., 2021 ). Dane te potwierdzają dowody na to, że B.1.351 i prawdopodobnie inne warianty mogą w pewnym stopniu być w stanie uniknąć odporności humoralnej wywołanej szczepionką ( Kustin i in., 2021 ). Ponadto miano PRNT i stężenia przeciwciał IgG po drugiej dawce były silnie skorelowane (Figura S1C). Korelacja była silniejsza dla B.1.1.7 i B.1.351 niż dla szczepu standardowego, zarówno dla anty-RBD, jak i anty-S.
https://www.mdpi.com/2076-393X/9/2/147/htm
Doniesiono, że szczepienie BNT162b2 aktywuje specyficzne dla wirusa limfocyty T CD4 + i CD8 + oraz reguluje w górę produkcję cytokin immunomodulujących, takich jak IFN-γ ( Sahin i wsp., 2020 ). W związku z tym oceniliśmy wydzielanie IFN-γ z komórek jednojądrzastych krwi obwodowej (PBMC) przed i po szczepieniu BNT162b2 w odpowiedzi na szczepy SARS-CoV-2 inaktywowane termicznie ( Ryc. 2A-2D ). Podczas gdy szczepienie BNT162b2 ogólnie wydaje się umiarkowanie zwiększać produkcję specyficznego IFN-γ po drugiej dawce szczepionki, osiągnęło to znaczenie statystyczne dopiero po stymulacji wariantem B.1.351 (Figura S2A-2C). Tę samą tendencję zaobserwowali również Tarke i wsp. którzy wykorzystali syntetyczne białka wariantów SARS-CoV-2 do wywołania podwyższonych odpowiedzi IFN-γ przeciwko B.1.351 ( Tarke i wsp., 2021). Produkcja IFN-γ była wyższa o co najmniej 50% u 37,5% badanych po stymulacji standardowym szczepem SARS-CoV-2, u 50% badanych po stymulacji wariantem B.1.1.7 i B.1.351 wariant, ale tylko u 18,75% badanych po stymulacji wariantem bawarskim (ryc. S1D). Odkrycia te dowodzą, że szczepienie BNT162b2 wywołuje lepszą humoralną niż komórkową odpowiedź immunologiczną. Wcześniej zgłaszano słabe odpowiedzi komórek T u osób zaszczepionych, które otrzymały tylko jedną dawkę BNT162b2 ( Prendecki et al., 2021 ; Stankov, Cossmann, Bonifacius, Dopfer-jablonka i Morillas, 2021). Co ciekawe, najlepsze odpowiedzi komórkowe po szczepieniu były przeciwko wariantowi B.1.351: fakt, że odpowiedzi neutralizujących przeciwciał przeciwko temu wariantowi były stosunkowo słabe, co może zwiększać prawdopodobieństwo, że ochronne działanie szczepionki BNT162b2 przeciwko temu wariantowi może być głównie zależne od komórek , a nie humoralne odpowiedzi. Nie zaobserwowano istotnych różnic między poszczególnymi wariantami. Bezwzględne stężenia cytokin po stymulacji można znaleźć w tabeli uzupełniającej 2.
Co ciekawe, zaobserwowaliśmy istotny heterologiczny wpływ szczepienia BNT162b2 na produkcję IFN-γ indukowaną również przez inne bodźce (ryc. S2E, 2F). Szczepienie BNT162b2 zmniejszyło produkcję IFN-γ po stymulacji agonistą TLR7 / 8 R848 (Figura S2F). W przeciwieństwie do tego, produkcja IFN-γ indukowana przez inaktywowany wirus grypy była zwykle wyższa dwa tygodnie po drugim szczepieniu BNT162b2, chociaż różnice nie osiągnęły istotności statystycznej. Nie znaleźliśmy żadnej istotnej korelacji między odpowiedziami komórkowymi a mianami przeciwciał IgG.
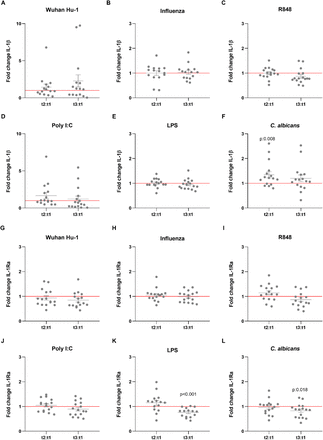
Oprócz wpływu na specyficzną (adaptacyjną) pamięć immunologiczną, niektóre szczepionki, takie jak Bacillus Calmette-Guérin (BCG) oraz szczepionka przeciwko odrze, śwince i różyczce (MMR), również indukują długoterminowe funkcjonalne przeprogramowanie komórek wrodzonego układu odpornościowego. ( Netea i in., 2020 ). Ten proces biologiczny jest również nazywany wytrenowaną odpornością, gdy obejmuje zwiększoną wrażliwość lub wrodzoną tolerancję immunologiczną, gdy charakteryzuje się zmniejszoną produkcją cytokin ( Ifrim et al., 2014). Chociaż efekty te zostały udowodnione głównie w przypadku żywych atenuowanych szczepionek, staraliśmy się zbadać, czy szczepionka BNT162b2 może również wywoływać wpływ na wrodzoną odpowiedź immunologiczną przeciwko różnym bodźcom wirusowym, bakteryjnym i grzybiczym. Jednym ze znaków towarowych wytrenowanej odporności jest podwyższona produkcja cytokin zapalnych w następstwie urazu wtórnego ( Quintin et al., 2012 ). Co zaskakujące, produkcja cytokin pochodzących z monocytów TNF-α, IL-1β i IL-1Ra wykazywała tendencję do zmniejszania się po stymulacji PBMC od osób zaszczepionych standardowym szczepem SARS-CoV-2 lub heterologicznymi ligandami receptora Toll-podobnego ( Rysunki 1 i 2 ). Produkcja TNF-α ( Rysunek 1B-1G) po stymulacji agonistą TLR7 / 8 R848 komórek jednojądrzastych krwi obwodowej pobranych od ochotników uległo znacznemu zmniejszeniu po drugim szczepieniu ( Figura 1C ). Ten sam trend obserwowano po stymulacji agonistą TLR3 poli I: C ( Figura 1D ), chociaż różnica nie osiągnęła istotności statystycznej. Natomiast odpowiedzi na grzybowy patogen Candida albicans były wyższe po pierwszej dawce szczepionki ( ryc. 1G ). Wpływ szczepienia na produkcję IL-1β był bardziej ograniczony ( Ryc. 2A-2F ), chociaż odpowiedź na C. albicans była znacznie zwiększona ( Ryc. 2F). Produkcja przeciwzapalnej cytokiny IL-1Ra (ryc.2G -2L ) została zmniejszona w odpowiedzi na bakteryjny lipopolisacharyd (LPS) i C. albicans po drugim szczepieniu ( ryc.2K, 2L ), co jest kolejnym argumentem przemawiającym za przesunięciem w kierunku silniejsze reakcje zapalne na bodźce grzybicze po szczepieniu. Odpowiedzi IL-6 były podobnie zmniejszone, chociaż mniej wyraźne (dane nieprzedstawione).
Ryc.1.Wytwarzanie TNF-α i IFN-α w odpowiedzi na heterologiczne bodźce w PBMC izolowanych od zaszczepionych osobników.
(A) Opis badania: dni szczepienia i pobrania krwi. (BG) Wartości krotnej zmiany produkcji TNF-α są obliczane indywidualnie dla każdego przedmiotu przez podział t2: t1 it3: t1. Dane przedstawiono jako krotność zmian ± SEM (n = 15-16) i analizowano za pomocą testu Wilcoxona w dopasowanych parach ze znakiem, porównując każdy stosunek do t1 = 1 (czerwona linia). (HI) Produkcja IFN-α (pg / ml) w czasie t1, t2 it3. Dane przedstawiono jako stężenie cytokin ± SEM (n = 15-16) i analizowano za pomocą testu zgodności par znakowanych Wilcoxona.
Rysunek 2.Wytwarzanie IL-1β i IL-1Rα w odpowiedzi na heterologiczne bodźce w PBMC izolowanych od zaszczepionych osobników.
Wartości zmiany krotności IL-1β (AF) i IL-1Ra (GL) oblicza się indywidualnie dla każdego badanego przez podział t2: t1 it3: t1. Dane przedstawiono jako krotność zmian ± SEM (n = 15-16) i analizowano za pomocą testu Wilcoxona w dopasowanych parach ze znakiem, porównując każdy stosunek do t1 = 1 (czerwona linia).
Indukcja tolerancji na stymulację ligandami TLR7 / 8 (R848) lub TLR4 (LPS) przez szczepienie BNT162b2 może wskazywać na bardziej zrównoważoną reakcję zapalną podczas zakażenia SARS-CoV-2 i można spekulować, czy taki efekt może być zatem przydatny do regulują potencjalne nadmierne zapalenie w COVID-19, jednej z głównych przyczyn zgonów ( Tang i wsp., 2020 ). Z drugiej strony hamowanie wrodzonej odpowiedzi immunologicznej może osłabiać odpowiedzi przeciwwirusowe. Interferony typu I również odgrywają kluczową rolę w patogenezie i odpowiedzi na infekcje wirusowe, w tym COVID-19 ( Hadjadj i wsp., 2020). Mając to na uwadze, oceniliśmy również produkcję IFN-α przez komórki odpornościowe ochotników po szczepieniu. Chociaż stężenia IFN-α były poniżej granicy wykrywalności testu dla większości bodźców, zaobserwowaliśmy znaczące zmniejszenie produkcji, jeśli IFN-α był wydzielany po stymulacji poli I: C i R848 po podaniu drugiej dawki. szczepionki ( Rysunek 1H, 1I ). Może to utrudniać początkową wrodzoną odpowiedź immunologiczną przeciwko wirusowi, ponieważ wykazano, że defekty TLR7 powodują zwiększoną podatność na COVID-19 u młodych mężczyzn ( Van Der Made i wsp., 2020 ). Wyniki te łącznie pokazują, że działanie szczepionki BNT162b2 wykracza poza adaptacyjny układ odpornościowy i może również modulować wrodzoną odpowiedź immunologiczną.
Wpływ szczepienia BNT162b2 na wrodzoną odpowiedź immunologiczną może również wskazywać na potencjalny wpływ na odpowiedzi na inne szczepienia, co jest znane w przypadku innych szczepionek jako „ interferencja szczepionki ” ( Lum i in., 2010 ; Nolan i in., 2008 ; Vajo, Tamas, Sinka i Jankovics, 2010). Konieczne są zatem przyszłe badania w celu zbadania tej możliwości, zwłaszcza potencjalnej interakcji ze szczepionką przeciw grypie: w nadchodzących latach (w tym jesienią 2021 r.) Programy szczepień COVID-19 prawdopodobnie będą się pokrywać ze szczepieniami przeciw grypie sezonowej, dlatego niezwykle ważne jest, aby dodatkowe badania mające na celu wyjaśnienie potencjalnych interakcji i skutków szczepionek COVID-19 z aktualnymi harmonogramami szczepień, zwłaszcza dla osób z obniżoną odpornością i osób starszych.
Możliwość uogólniania tych wyników podlega pewnym ograniczeniom. Po pierwsze, liczba ochotników w tym badaniu była stosunkowo niewielka, chociaż zgodnie z wcześniejszymi badaniami immunologicznymi dotyczącymi skutków szczepionek COVID-19. Po drugie, nasza kohorta składała się z pracowników służby zdrowia, którzy są w średnim wieku i zdrowi, a przyszłe badania na osobach starszych i osobach ze współistniejącymi chorobami i innymi czynnikami ryzyka wystąpienia ciężkich zakażeń COVID-19 muszą zostać przeprowadzone ( Gao i in., 2021). Po trzecie, nasze badanie dotyczy tylko osób z zachodnioeuropejskim pochodzeniem. Dlatego wnioski z naszego badania należy przetestować w populacjach o różnym pochodzeniu i alternatywnych stylach życia, ponieważ indukcja wrodzonej i adaptacyjnej odpowiedzi immunologicznej jest w dużej mierze zależna od różnych czynników, takich jak podłoże genetyczne, dieta i ekspozycja na bodźce środowiskowe, które znacznie różnią się między społecznościami. dookoła świata.
Podsumowując, nasze dane pokazują, że szczepionka BNT162b2 wywołuje wpływ zarówno na adaptacyjną, jak i wrodzoną gałąź odporności i że te efekty są różne dla różnych szczepów SARS-CoV-2. Co ciekawe, szczepionka BNT162b2 wywołuje również przeprogramowanie wrodzonej odpowiedzi immunologicznej i należy to wziąć pod uwagę: w połączeniu z silną adaptacyjną odpowiedzią immunologiczną może to przyczynić się do bardziej zrównoważonej reakcji zapalnej podczas zakażenia COVID-19 lub może przyczynić się do do zmniejszonej wrodzonej odpowiedzi immunologicznej przeciwko wirusowi. Szczepionka BNT162b2 wyraźnie chroni przed COVID-19, ale czas trwania tej ochrony nie jest jeszcze znany i można sobie wyobrazić, że przyszłe generacje szczepionki będą uwzględniać tę wiedzę w celu poprawy zakresu i czasu trwania ochrony.
Dostępność danych
Dane z tego badania są dostępne na życzenie.
Autorskie Wkłady
Konceptualizacja: MGN, FKF, JtO, JH, RvC, JvdM, FvdV i LABJ; Badanie kliniczne: FKF; Prace eksperymentalne: JD-A, BG, GK, OB, ES, BLH, GJO, CGvK, HD, HL, SAS, MR; Nadzór: RPvR, MIdJ, JD-A. oraz MGN. Pisanie i korekta manuskryptu: wszyscy autorzy.
Deklaracja interesów
MGN i LABJ są założycielami naukowymi Trained Therapeutix and Discovery.
Metody
Dostępność zasobów
Główny kontakt
Dalsze informacje i prośby o zasoby i odczynniki powinny być kierowane do głównego kontaktu Mihai G. Netea i przez niego realizowane ( mihai.netea@radboudumc.nl ).
Dostępność materiałów
To badanie nie wygenerowało nowych unikalnych odczynników.
Dostępność danych i kodu
Dane z tego badania są dostępne na życzenie.
Model eksperymentalny i szczegóły przedmiotu
Kolekcja ludzi
Badanie zostało przeprowadzone zgodnie z zasadami etycznymi Deklaracji Helsińskiej, zatwierdzonej przez Arnhem-Nijmegen Institutional Review Board (protokół NL76421.091.21) i zarejestrowanej w European Clinical Trials Database (2021-000182-33). Do badania włączono pracowników służby zdrowia z Radboudumc Nijmegen, którzy otrzymali szczepionkę BNT162b2 mRNA Covid-19 zgodnie z ogólnokrajową kampanią szczepień i wyrazili świadomą zgodę. Badani (n = 16) byli w wieku 26-59 lat, zarówno mężczyźni, jak i kobiety, i byli zdrowi (dane demograficzne przedstawiono w tabeli uzupełniającej 1). Kluczowe kryteria wykluczenia obejmowały historię medyczną COVID-19. Surowice i próbki krwi pobierano przed pierwszym podaniem BNT162b2, trzy tygodnie po pierwszej dawce (tuż przed drugą dawką) i dwa tygodnie po drugiej dawce. Wysoki odsetek (56. 3%) osób zostało zaszczepionych BCG w ciągu ostatnich 12 miesięcy ze względu na fakt, że wielu uczestników równolegle uczestniczyło w badaniu BCG. Jedna osoba została usunięta ze zbioru danych po wykryciu wysokich stężeń przeciwciał przeciwko antygenowi N SARS-CoV-2 na początku badania.
Izolacja i sekwencjonowanie wirusa
Wirusy izolowano z materiału diagnostycznego na wydziale Viroscience, Erasmus MC, a następnie sekwencjonowano, aby wykluczyć dodatkowe mutacje w białku S: D614G (BetaCoV / Munich / BavPat1 / 2020, European Virus Archive 026V-03883), B.1.1. 7 (GISAID: hCov-465 19 / Holandia / ZH-EMC-1148) i B.1.351 (GISAID: hCov-19 / Holandia / ZH-EMC-1461). Izolat SARS-CoV-2 BetaCoV / Munich / BavPat1 / 2020 (European Virus Archive 026V-03883), został udostępniony przez prof. C. Drostena. Szczep SARS-CoV-2 Wuhan Hu-1 został udostępniony przez prof. Heinera Schaala (Uniwersytet w Dusseldorfie, Niemcy). Izolaty B.1.1.7 i B.1.351 izolowano z próbek diagnostycznych na komórkach gruczolakoraka płuc Calu-3 przez trzy pasaże. Pasaż 3 Warianty BavPat1, B.1.1.7 i B.1.351 zastosowano do zakażenia komórek Vero E6 przy MOI 0,01 w DMEM, o wysokiej zawartości glukozy (Thermo Fisher Scientific, USA, nr kat. 11965092) uzupełniony 2% płodową surowicą bydlęcą (Sigma-Aldrich, Niemcy, nr kat. F7524), 20 mM HEPES (Thermo Fisher Scientific, USA, nr kat. 15630056) i 50 U / ml penicyliny – 50 µg / ml streptomycyna (Thermo Fisher Scientific, USA, nr kat. 15070063) w 37 ° C w nawilżanym inkubatorze z 5% CO2. 72 godziny po infekcji supernatant hodowli wirowano przez 5 minut przy 1500xgi przesączono przez 0,45 µM filtr o niskim wiązaniu białek (Sigma-Aldrich, Niemcy, nr kat. SLHPR33RS). W celu dalszego oczyszczenia wirusów, pożywkę przeniesiono na kolumnę Amicon Ultra-15 z odcięciem 100 kDa (Sigma-Aldrich, Niemcy, nr kat. UFC910008), którą przemyto 3 razy przy użyciu Opti-MEM uzupełnionej GlutaMAX (Thermo Fisher Scientific , USA, nr kat. 51985034). Następnie zatężony wirus na filtrze rozcieńczono z powrotem do pierwotnej objętości przy użyciu Opti-MEM i oczyszczone podwielokrotności wirusa przechowywano w -80 ° C. Miana zakaźnych wirusów mierzono za pomocą testów łysinkowych, jak opisano ( Varghese i wsp., 2021 ) i zapasy inaktywowano termicznie przez 60 minut w 56 ° C do wykorzystania w eksperymentach stymulacyjnych.
Pomiar poziomu przeciwciał przeciwko białku RBD i Spike
Aby zmierzyć poziomy przeciwciał przeciwko RBD i białku Spike, opracowano multipleksowy test immunologiczny oparty na kulkach fluorescencyjnych (MIA), jak opisano wcześniej w ( Fröberg et al., 2021). Stabilizowaną przed fuzją konformację ektodomeny białka Spike (aminokwasy 1 – 1213) połączonego z motywem trimeryzacyjnym GCN4 (białko S) i domeną wiążącą receptor białka S (RBD) sprzężono z kulkami lub mikrosfery z wyraźnymi widmami wzbudzenia i emisji fluorescencji. Próbki surowicy rozcieńczono i inkubowano z mikrosferami sprzężonymi z antygenem. Po inkubacji mikrosfery przemyto i inkubowano ze sprzężoną z fikoerytryną kozim przeciwciałem przeciw ludzkim, IgG, IgA i IgM. Dane uzyskano w systemie Luminex FlexMap3D. Średnie natężenia fluorescencji (MFI) przeliczono na jednostki arbitralne (AU / ml) przez interpolację z logistycznej krzywej standardowej z parametrem log-5PL i transformacji log-log w osi, przy użyciu oprogramowania Bioplex Manager 6.2 (Bio-Rad Laboratories).
Test neutralizacji redukcji łysinek
Wykonano test neutralizacji redukcji łysinek (PRNT). Wirusy użyte w teście wyizolowano z materiału diagnostycznego na wydziale Viroscience, Erasmus MC, wyhodowano, a następnie zsekwencjonowano, aby wykluczyć dodatkowe mutacje w białku S: D614G (GISAID: hCov-19 / Holandia / ZH-EMC-2498), B.1.1.7 (GISAID: hCov-19 / Holandia / ZH-EMC-1148) i B.1.351 (GISAID: hCov-19 / Holandia / ZH-EMC-1461). Surowice inaktywowane termicznie rozcieńczono 2-krotnie w pożywce Eagle zmodyfikowanej przez Dulbecco uzupełnionej NaHCO3, buforem HEPES, penicyliną, streptomycyną i 1% płodową surowicą bydlęcą, zaczynając od rozcieńczenia 1:10 w 60 μl. Następnie dodaliśmy 60 μl zawiesiny wirusa (400 jednostek tworzących łysinki) do każdego dołka i inkubowano w 37 ° C przez 1 godzinę. Po 1 godzinie inkubacji przenieśliśmy mieszaniny do komórek Vero-E6 i inkubowano przez 8 godzin. Po inkubacji utrwaliliśmy komórki 10% formaldehydem i wybarwiliśmy komórki poliklonalnym króliczym przeciwciałem przeciw SARS-CoV (Sino Biological) i drugorzędowym kozim przeciwciałem przeciw króliczej IgG wyznakowanym peroksydazą (Dako). Wykryliśmy sygnał przy użyciu osadu tworzącego substrat 3,3 ’, 5,5′-tetrametylobenzydyny (True Blue; Kirkegaard i Perry Laboratories) i policzyliśmy liczbę zakażonych komórek na dołek przy użyciu analizatora obrazu ImmunoSpot (CTL Europe GmbH). Miano neutralizacji surowicy jest odwrotnością najwyższego rozcieńczenia skutkującego redukcją infekcji o> 50% (PRNT50). Na podstawie walidacji testu uznaliśmy miano> 20 za pozytywne Wykryliśmy sygnał przy użyciu osadu tworzącego substrat 3,3 ’, 5,5′-tetrametylobenzydyny (True Blue; Kirkegaard i Perry Laboratories) i policzyliśmy liczbę zakażonych komórek na dołek przy użyciu analizatora obrazu ImmunoSpot (CTL Europe GmbH). Miano neutralizacji surowicy jest odwrotnością najwyższego rozcieńczenia skutkującego redukcją infekcji o> 50% (PRNT50). Na podstawie walidacji testu uznaliśmy miano> 20 za pozytywne Wykryliśmy sygnał przy użyciu osadu tworzącego substrat 3,3 ’, 5,5′-tetrametylobenzydyny (True Blue; Kirkegaard i Perry Laboratories) i policzyliśmy liczbę zakażonych komórek na dołek przy użyciu analizatora obrazu ImmunoSpot (CTL Europe GmbH). Miano neutralizacji surowicy jest odwrotnością najwyższego rozcieńczenia skutkującego redukcją infekcji o> 50% (PRNT50). Na podstawie walidacji testu uznaliśmy miano> 20 za pozytywne
Izolacja komórek jednojądrzastych krwi obwodowej
Próbki krwi od pacjentów pobierano do probówek pokrytych EDTA (BD Bioscience, USA) i stosowano jako źródło komórek jednojądrzastych krwi obwodowej (PBMC) po pobraniu próbek surowicy od każdego osobnika. Krew rozcieńcza się 1: 1 za pomocą PBS (1X) bez Ca ++, Mg ++ (Westburg, Holandia, nr kat. LO BE17-516F) i izoluje PBMC za pomocą wirówki z gradientem gęstości przy użyciu Ficoll-PaqueTM-plus (VWR, Holandia, nr kat. 17-1440-03P). Probówki użyte do izolacji były specjalnymi probówkami SepMate-50 (Stem Cell Technologies, nr kat. 85450), aby zapewnić lepszą separację. Liczbę komórek określono za pomocą analizatora hematologicznego Sysmex XN-450. Następnie PBMC zamrożono stosując Recovery Cell Culture Freezing (Thermo Fisher Scientific, USA, nr kat. 12648010) w stężeniu 15 x 106 / ml.
Eksperymenty symulacyjne
PBMC rozmrożono i przemyto 10 ml zmodyfikowanej holenderskiej pożywki RPMI 1640 (Roswell Park Memorial Institute; Invitrogen, USA, nr kat. 22409031) zawierającej 50 µg / ml gentamycyny (Centrafarm, Holandia), 1 mM pirogronianu sodu (Thermo Fisher Scientific, USA, nr kat. 11360088), 2 mM Glutamax (Thermo Fisher Scientific, USA, nr kat. 35050087) z dodatkiem 10% bydlęcej surowicy cielęcej (Fisher Scientific, USA, nr kat. 11551831) dwukrotnie, a następnie komórki zliczono za pomocą Sysmex XN- 450. PBMC (4 × 10 5komórek / dołek) stymulowano w sterylnych okrągłodennych 96-dołkowych płytkach do hodowli tkankowej (VWR, Holandia, nr kat. 734-2184) w holenderskiej zmodyfikowanej pożywce RPMI 1640 zawierającej 50 µg / ml gentamycyny, 1 mM pirogronianu sodu, 2 mM Glutamax uzupełniony 10% połączoną surowicą ludzką. Stymulację prowadzono SARS-CoV-2 Wuhan Hu-1 szczepu inaktywowanej termicznie (3,3 x 10 3 TCID50 / ml), SARS CoV B.1.1.7-2 (3,3 x 10 3 TCID50 / ml), SARS-CoV -2 B.1.351 (3,3 x 10 3 TCID50 / ml) i odmiany bawarskie SARS-CoV-2 (3,3 x 10 3 TCID50 / ml), grypa (3,3 x 10 5 TCID50 / ml), 10 µg / ml Poly I : C (Invivogen, USA, nr kat. Tlrl-pic), 3 µg / ml R848 (Invivogen, USA, nr kat. Tlrl-r848), 10 ng / ml LPS E. coli i 1 x 10 6/ ml C. albicans . PBMC inkubowano ze stymulantami przez 24 godziny w celu wykrycia IL-1β, TNF-α, IL-6, IL-1Ra i 7 dni w celu wykrycia IFN-γ. Supernatanty zebrano i przechowywano w – 20 ° C. Poziomy wydzielanych cytokin z supernatantów oznaczono ilościowo za pomocą testu ELISA (IL-1β nr kat. DLB50, TNF-α nr kat. STA00D, IL-6 nr kat. D6050, IL-1Ra nr kat. DRA00B, IFN-γ nr kat. DY285B, R&D Systems, USA) .
Analiza statystyczna
Do wszystkich analiz statystycznych zastosowano Graphpad Prism 8. Wyniki pomiędzy sparowanymi grupami analizowano za pomocą testu dobranych par ze znakiem Wilcoxona. Trzy lub więcej grup porównano za pomocą testu Kruskala-Wallisa – wielokrotnego porównania Dunneta. Wartość p poniżej 0,05 uznano za istotną statystycznie. Do określenia korelacji między grupami wykorzystano korelację Spearmana.
90% obniżenia śmiertelności – witamina D jest skuteczna w przypadku COVID-19.
Masowe Szczepienia – Tragedia w Izraelu, która powtarza się właśnie dziś teraz tu w Polsce !!!
Covid-19 – układ odpornościowy zapewnia trwałą obronę po wyzdrowieniu
Originally posted 2021-05-18 08:34:10.